


多系统萎缩(multiple system atrophy,MSA)是一种散发性神经系统退行性疾病,多于中老年期发病,临床表现为对左旋多巴类药物反应不良的帕金森综合征、小脑性
MSA病因尚未明确,普遍认为该病是一种散发性疾病,很少有家族史,但遗传因素也可能参与了MSA的发病机制。
研究认为MSA的发病机制可能有两种途径:①原发性少突胶质细胞病变假说。②神经元本身α-突触核蛋白异常聚集。
目前MSA尚缺乏有效的药物[23],该病累及人体多个系统,主要针对特定临床症状进行对症治疗,因此,需要包括神经内科、心脏内科、精神科、睡眠医学科、肾内科、泌尿外科等多学科的联合治疗。患者家庭和社会关怀及支持治疗也十分重要。
本病病因不明,尚无明确有效的预防措施,可尽量避免外源性毒物接触,如有机溶剂、塑料单体、食品添加剂、杀虫剂和重金属等。
多系统萎缩(multiple system atrophy,MSA)是一种散发性神经系统退行性疾病,多于中老年期发病,临床表现为对左旋多巴类药物反应不良的帕金森综合征、小脑性
MSA中老年期发病,男女受累机会均等,中国目前尚无完整的流行病学资料。该病迄今缺乏有效的治疗手段,有着极高的病死率和病残率,从首发症状进展至运动障碍(锥体系、锥体外系和小脑性运动障碍)和自主神经系统功能障碍的平均时间为2年(1~10年);从发病到需要协助行走、轮椅、卧床不起和死亡的平均间隔时间各自为3、5、8和9年,罕见有存活15年的报道[5]。
欧美国家的平均发病率为0.6~0.7/10万人[4]。
欧美国家的患病率为1.9~4.4/10万人,40岁以上人群中MSA的患病率升高至7.8/10万人,50岁以上人群中MSA的患病率为3/10万人[4]。
MSA病因尚未明确,普遍认为该病是一种散发性疾病,很少有家族史,但遗传因素也可能参与了MSA的发病机制。全基因组单核苷酸多态性关联性分析显示,α-突触核蛋白基因(SNCA)rs11931074、rs3857059、rs3822086位点多态性可增加MSA患病风险,其他候选基因包括COQ2、 GBA、 MAPT、 LRRK2、 C9orf72基因等[6]。
环境因素尚不明确,有报道发现部分患者有外源性毒物接触史(如有机溶剂、塑料单体、食品添加剂、杀虫剂和重金属等)[7]。但这些危险因素尚未完全证实。
黄晶晶等人纳入100例MSA患者探讨MSA患者认知损害的危险因素,结果发现:MSA患者认知损害是多因素共同作用的结果,其中年龄是独立危险因素,受教育年限是独立保护因素,饮酒可能是其潜在的危险因素[8]。
研究认为MSA的发病机制可能有两种途径。
即先是以α-突触核蛋白(α-synuclein)阳性包涵体为特征的少突胶质细胞变性,导致神经元髓鞘变性脱失,激活小胶质细胞,诱发氧化应激,进而导致神经元变性死亡。
神经元本身α-突触核蛋白异常聚集,造成神经元变性死亡。α-突触核蛋白异常聚集的原因尚未明确,可能与遗传易感性和环境因素有关。
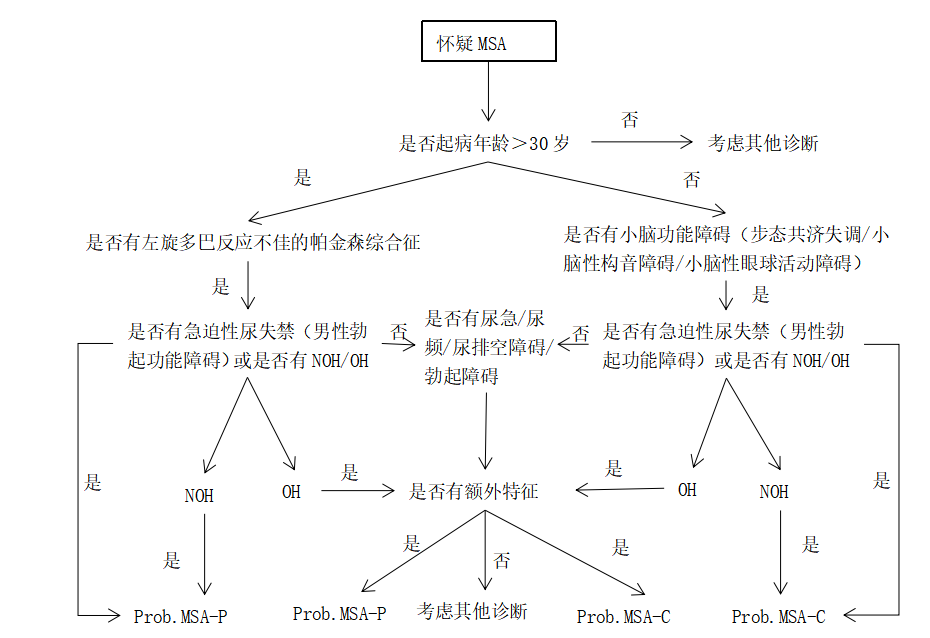
注:MSA:多系统萎缩;OH:
图1 多系统萎缩的诊断流程图[9]
本病多为成年期缓慢起病、逐渐进展,既往史、个人史无特殊,通常为散发病例,无家族史,首发症状多为自主神经功能损害、帕金森综合征和小脑性
MSA的核心临床表现包括:帕金森综合征、小脑综合征、泌尿系统功能障碍、心血管自主神经功能障碍。早期出现进展性的严重自主神经功能障碍是MSA的主要特征,并影响患者的生存期[4]。
通常为首发症状,主要表现为心血管功能障碍(如
● 喘鸣:患者由于声门裂狭窄在睡眠或清醒时发出高调的吸气声,夜间吸气性喘鸣常与睡眠呼吸暂停同时存在,尤其在晚期患者中更多见[12];
● MSA患者可见多种形式的
● 吸气性叹息:表现为不自主地深吸气叹息或喘息,常见于非快速眼动(non‑rapid eye movement,NREM)睡眠期的N1、N2期;
● 冷手冷脚和肤色变化(紫色或蓝色),按压可发白,恢复较慢;
● 强哭强笑,即突然出现不受控制和不合时宜的大哭或大笑[4]。
MSA患者通常不伴有
洪霞等人利用多导睡眠图对13例MSA患者和17例健康对照者进行监测,发现以下3点:
①MSA患者相较于健康人群存在明显的
②MSA 患者在遭遇负性生活事件时相较健康人群更多的使用自责、接受及灾难化三种非适应调节策略。
③MSA患者的
为MSA-P亚型的突出症状,与黑质纹状体变性有关,主要表现为运动迟缓,伴肌强直、震颤,易出现姿势平衡障碍,双侧同时受累,症状可轻重不同;但
为MSA-C亚型的突出症状,主要表现为进行性步态和肢体
测试平卧位、直立位的血压和心率,站立3分钟内血压较平卧位下降≥30/15mmHg,且心率无明显变化者为阳性。
表现为为运动迟缓,慌张步态,伴单侧或者双侧肢体震颤,肌强直或齿轮样肌张力增高。伴姿势反射障碍,行走时上肢摆动幅度减少或消失,下肢拖曳。
表现为站立不稳,走路时步基加宽、左右摇摆、不能沿直线行走、蹒跚而行,又称醉汉步态。协调运动障碍,不能完成复杂而精细的动作,如穿衣、系扣、书写等;有明显的小脑性
MSA-P患者DWI序列上壳核区域弥散系数明显增高,而MSA-C患者小脑和小脑中脚区域弥散系数明显增高。
磁共振弥散加权成像(diffusion weighted image,DWI)对MSA具有较高的敏感性和特异性,其即弥散系数可作为MSA诊断并区分其亚型及分型的有效指标。
有助于早期发现神经源性膀胱功能障碍。膀胱B超有助于测量残余尿量,残余尿量超过100ml是确定膀胱排空障碍、诊断MSA的重要指标。
测量患者平卧位和直立位的血压和心率,规定站立3分钟内血压较平卧时下降≥30/15mmHg、且心率无明显变化者为阳性(体位性低血压),舒张压变化不作为必要条件。
针对有RBD、鼾症、喘鸣病史或主诉的患者。
针对帕金森型MSA患者。
可检测患者
尿流动力学试验主要检测尿流率、膀胱收缩指数、膀胱顺应性等指标。
可发现尿道括约肌功能减退、逼尿肌反射兴奋性升高,疾病后期出现残余尿增加。
纤维喉镜可发现患者声带出现外展障碍或矛盾内收运动
排除器质性声带病变(如肿块或瘢痕)或非 MSA 神经源性声带功能障碍。
123I-MIBG 心肌摄取检查可反映节后交感神经突触前末梢功能。
该检查有助于区分自主神经功能障碍是交感神经节前或节后病变。
需排除马尾损伤、盆底手术和产科盆底撕裂等可能导致慢性神经再生的几种情况,但该
肛门外括约肌
体温调节汗液试验(thermoregulatory sweat testing,TST)可评估患者整体的出汗功能,定量催汗轴突反射试验(quantitative sudomotor axon reflex testing,QSART)可评估节后交感排汗纤维的功能。TST和QSART的组合可用于判断节前、节后或混合型泌汗功能异常。
MSA患者通常表现出正常的血浆NE水平(>100 pg/ml),而伴有nOH的
利用PMCA技术扩增脑脊液中的α‑突触核蛋白寡聚体后,通过硫黄素T荧光来反映扩增后的纤维含量。
MSA患者脑脊液中的α-突触核蛋白扩增后硫黄素T荧光值低于2 000,而
可用于鉴别MSA与
尽管脑脊液(Cerebrospinal Fluid,CSF)生物标志物正在积极研究中,但没有实验室检查可以确认MSA的诊断。
一项研究发现,与对照组和PD患者相比,MSA患者的CSF神经丝轻链水平升高。与PD患者相比,MSA患者的CSFDJ-1、总tau水平显著升高,并且这些蛋白质的组合在区分MSA与PD方面的敏感性为82%,特异性为81%[15]。
MSA 患者中 α‑突触核蛋白通常沉积于体神经纤维末端,
Stankovic等强调,大约1/3的MSA患者存在认知损害,特别是额叶执行功能如注意力缺陷和工作记忆能力下降[16]。临床应首选蒙特利尔认知评估(Montreal Cognitive Assessment,MoCA)、简易精神状态检查量表(Mini-Mental State Examination,MMSE)、额叶功能评分(Frontal Assessment Battery)等进行初筛。
利用汉密尔顿抑郁量表(Hamilton Depression Rating Scale)、汉密尔顿焦虑量表(Hamilton Anxiety Rating Scale)进行抑郁和焦虑情绪评价 。
明确是否存在轻度认知损害或
有助于对MSA患者认知功能及精神心理状态进行评估,以便早期诊断和治疗。
单光子发射计算机断层成像术(single photon emission computed tomography,SPECT)检查可发现突触前黑质纹状体多巴胺能失神经改变[17]。
18氟-氟代脱氧葡萄糖-正电子发射体层摄影(18F-fluorodeoxyglucose-positron emission tomography,18F-FDG-PET)显示MSA患者壳核(后侧)、脑桥和小脑处于低代谢。
18氟-氟代脱氧葡萄糖-正电子发射体层摄影(18F-fluorodeoxyglucose-positron emission tomography,18F-FDG-PET可用于MSA与PD的鉴别。颅脑氢质子磁共振波谱、基于体素形态学测量、经颅多普勒超声等检查对于MSA的分型和鉴别诊断可能有一定的帮助。
目前MSA尚无明确的致病基因,但研究发现COQ2基因、SNCA基因变异位点可增加MSA的发病风险[18,19]。
根据成年期缓慢起病(>30岁)、无家族史、临床表现为逐渐进展的自主神经功能障碍、帕金森综合征和小脑性
1.神经病理确诊的MSA诊断标准
尸检病理结果显示中枢神经系统大量胶质细胞胞质内存在以α-突触核蛋白为主要成分的嗜酸性包涵体(glial cytoplasmic inclusions,GCIs),并伴有橄榄脑桥小脑萎缩或黑质纹状体变性。
2.前驱可能的MSA诊断标准
表1 前驱可能的MSA诊断标准[4,20]
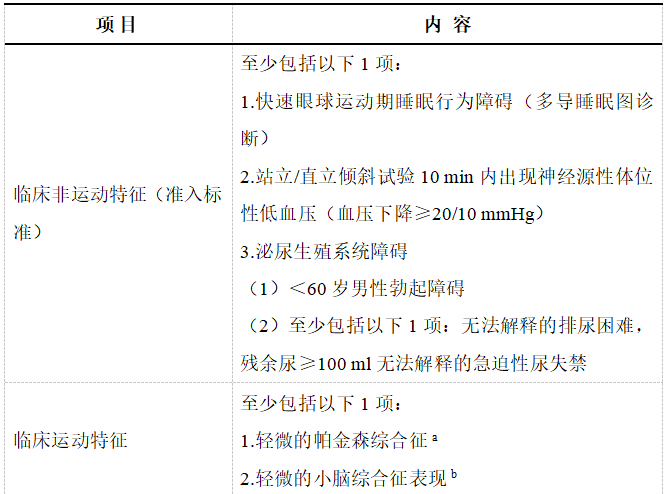

注:a有不满足帕金森综合征诊断标准的帕金森样临床表现,运动障碍专家判定症状为轻微,不需要多巴胺药物治疗;b 至少包括串联步态异常、步态
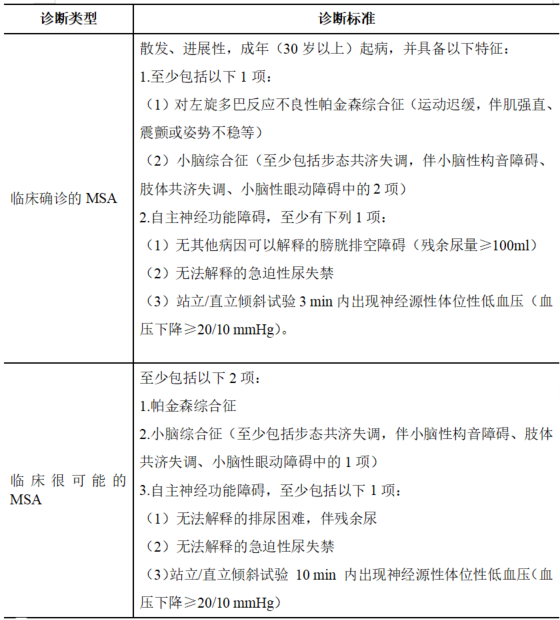
3. 临床确诊的MSA和临床很可能MSA的诊断标准
表2 临床确诊的MSA和临床很可能MSA的诊断标准[4,20]
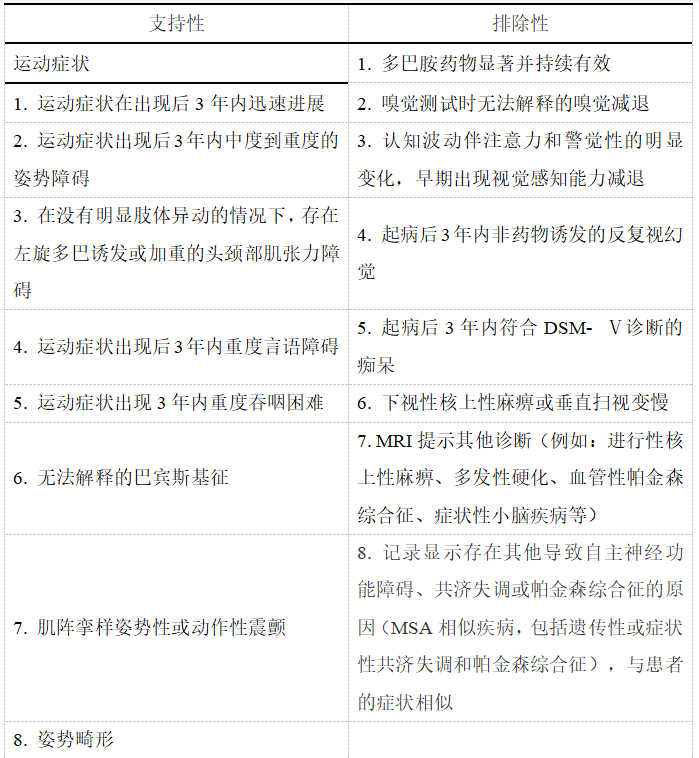
临床确诊的MSA至少存在表3中2项,临床很可能的MSA至少存在表3中1项。
表3 MSA的支持性临床表现和排除性临床表现[4,20]

临床确诊的MSA至少存在1项MRI标志,临床很可能的MSA不要求MRI标志。1处脑区萎缩或弥散系数增加或该脑区同时存在萎缩和弥散系数增加均为1个MRI标志。
表4 MSA的MRI标志[4,20]

MSA可导致多种并发症:
1.跌倒
平衡感不佳或晕倒。
2.损伤
长久不动而导致的皮肤损伤,如压疮。
3.
包括声带麻痹所致喘鸣、夜间呼吸暂停等,严重时需气管切开。
4.肺部感染
长期卧床所致坠积性肺部改变、
5.营养不良
长时间患病丧失自理能力及
6.泌尿系感染
自主神经功能障碍所致尿潴留,长期排尿不畅可增加泌尿系感染风险。
PD患者的运动症状对多巴胺能药物的疗效明确且显著有效,常伴静止性震颤与嗅觉减退。MSA-P型患者对左旋多巴疗效欠佳,可伴有姿势性与动作性震颤,嗅觉减退少见,早期出现进展性的自主神经功能障碍。
借助MRI、18F-FDG‑PET、经颅超声成像、123I‑MIBG-心肌显像等进行鉴别。
VP特征表现为双下肢症状突出的帕金森综合征,伴有步态紊乱、锥体束征和假性延髓性麻痹。
借助MRI可进行鉴别。
PSP特征表现有垂直性核上性眼肌麻痹或垂直扫视变慢,特别是下视麻痹,较MSA更早出现反复的自发性摔倒与冻结步态;MSA-P型患者可表现出小脑性
两者可借助神经影像学检查进行鉴别。
表现为异己手(肢)综合征(alienhandsyndrome)、口颊或肢体失用、皮质复合感觉障碍、不对称性肌强直、肢体肌张力障碍、刺激敏感的肌阵挛等有临床表现,MSA-P型患者四肢肌强直多对称,且少见口颊或肢体失用、皮质复合感觉障碍以及异已手(肢)综合征等。
两者可借助结构神经影像学进行鉴别。
较早出现认知功能障碍,执行功能和视觉空间能力的损害,在注意力与警觉方面呈波动性认知障碍,伴有反复发作的视幻觉。MSA-P型患者多不伴有认知障碍与视幻觉。
两者可借助神经影像学检查进行鉴别[4]。
MSA-C应与多种小脑性
二者共同的临床特点包括起病年龄较晚的小脑性
基因检测可以发现FMR1基因5非翻译区存在CGG三核苷酸重复序列前突变改变,可与MSA鉴别[21,22]。
易误诊人群
MSA首发症状多为自主神经系统损害、帕金森综合征和小脑性
本病被误诊为其他疾病
本病早期症状复杂多变,缺乏典型、特征性临床表现,常易误诊为
其他疾病被误诊为本病
1. 遗传性脊髓小脑性
2.
3. 皮质基底节变性。
避免误诊的要点
在疾病早期,特别是临床上只表现为单一系统症状时,容易漏诊,误诊,故需熟练掌握该病的临床特点及诊断标准。
本病病因不明,尚无明确有效的预防措施,可尽量避免外源性毒物接触,如有机溶剂、塑料单体、食品添加剂、杀虫剂和重金属等。
现代医学对于MSA的康复治疗通常以药物联合物理康复训练为主,对不同症状辅以不同的康复治疗,如平衡训练、运动疗法、吞咽训练等,辅以针灸、理疗、传统训练如五禽戏、太极拳等,可不同程度改善患者运动症状及自主神经症状等。
该病迄今缺乏有效的治疗手段,且病情进展快,症状复杂多样,故长期随访有助于对不同病程阶段的患者进行合适的治疗和护理指导。建议每隔半年门诊随访,以评估下一阶段治疗方案。
MSA患者在疾病的早期,患者的临床表现可能各有侧重,但随病程进展,各种临床表现可以重叠组合,最终呈现全部的临床表现,因此,MSA患者在配合治疗的同时,应在日常生活中注意以下几点:
1.应少食多餐,每餐不宜过饱,避免餐后低血压反应。
2.体位性低血压的患者适当增加盐的摄入量,但如卧位血压较高应慎重;可穿弹力袜,增加下肢静脉压力,增加回心血量;睡眠期间抬高头位。
3.不要饮酒。
4.排尿异常可增加泌尿系感染机会,对于尿急尿频的患者应注意局部清洁;尿潴留患者必要时导尿。
5.养成定时排便的习惯,并增加纤维含量高的食物摄入。
6.周围环境温度不宜过高。
7.对于进食差的患者,必要时留置胃管。
8.应避免突然从卧位或坐位起立,在站起之前先作踢腿动作,日常活动中应避免动作过快过猛。
9. 对于卧床患者勤翻身、拍背。
10.对于
本站内容仅供医学专业人士参考
不能作为诊断及医疗依据,请谨慎参阅
©医知源 版权所有,未经许可,不得以任何形式对医知源内容和插图进行转载使用。



 长按文字
长按文字