
先天性肥厚性幽门狭窄(congenital hypertrophic pyloric stenosis,CHPS)是由幽门肌层先天性肥厚,引起胃出⼝近乎完全梗阻,是常见的消化道畸形疾病之一,以无胆汁性呕吐为主要表现,并可加重呈喷射性,严重者可有脱水、营养不良、代谢紊乱等表现。
本病多见于足月新生儿或小婴儿,发生率约为1/3000~1/1000,多见于男婴[1]。病因尚不清楚,可能受遗传因素和环境因素共同影响。
该病的诊断主要依据典型的临床表现,腹部可触及橄榄状肿块即可初步诊断,超声检查是辅助诊断的重要手段。
明确诊断后应在对症处理后尽早实施矫正手术,手术治疗的死亡率很低,预后良好[1-3]。
先天性肥厚性幽门狭窄(congenital hypertrophic pyloric stenosis,CHPS)是由于幽门环肌肥厚、增生压迫幽门管引起的上消化道不全梗阻性疾病,以无胆汁性呕吐、右上腹橄榄样包块为主要表现[3,4]。
该病好发于男婴,男⼥⽐例约为5:1,且30%~40%的病例发⽣于第1胎[1,3]。CHPS的症状通常始于出⽣后2~3周,极少数患⼉在出⽣12周后才出现症状[4-6]。
各国家、各地区报道的CHPS的发病率不一致,约每1000例活产⼉中有1~4例发生CHPS[4,5]。
本病病因至今尚无统一意见,可能受遗传易感性和其他多因素影响。目前多数研究者认为由于先天性发育缺陷,幽门肌间神经丛减少及神经节细胞发育不成熟,使幽门肌长期处于痉挛状态,导致幽门肌肉肥厚和管腔狭窄而发生梗阻。
一项研究报道显示,在CHPS的患病家庭中,遗传率为87%,CHPS具有家族聚集性[7]。
有人认为本病为多基因遗传病,其遗传度较高,父母患病,子、女的发病率分别为20%和7%;父亲患本病,子、女的发病率各为5%和2.5%,且发生于同卵双胞胎比异卵双胞胎更为常见[4]。
一项关于全基因组的研究发现,出生时血浆胆固醇水平低是CHPS发生的危险因素,其发生机制可能与一个包含载脂蛋白A1基因簇的易感位点有关 [8]。
(1)有学者提出本病的原因是胃肠激素代谢异常,导致幽门括约肌处于持续收缩状态[3]。
(2)多数人认为幽门肌间神经丛和神经节细胞减少导致的副交感神经功能异常,也可能是本病发生的原因[4]。
(3)国外有报道显示新生儿出生后2周内应用红霉素、阿奇霉素治疗可增加本病的发病危险,但尚未得到公认[9,10]。
(4)一项Meta分析调查了与本病发病相关的围产期因素,其报告显示第一胎、剖宫产、
CHPS的诊断主要依据典型的临床表现,腹部可触及橄榄状肿块即可初步临床诊断,超声检查是辅助确诊的重要手段[3]。
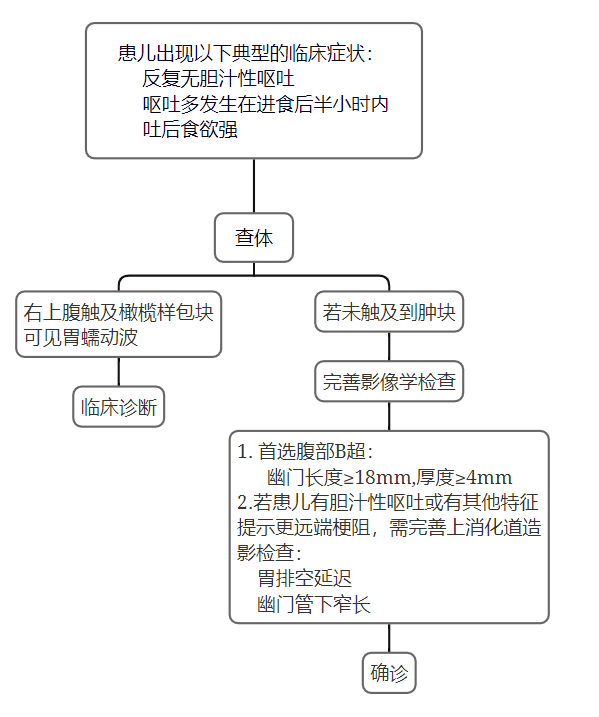
图1 CHPS的诊断流程[3]
需详细询问呕吐病史,有无脱水、
(1)详细询问患儿呕吐的特点,包括:
● 呕吐物颜色
● 呕吐时机
● 是否为喷射性呕吐
● 吐后是否有明显的饥饿表现。
(2)询问有无以下表现:
● 脱水
● 营养不良
● 碱中毒
●
需询问以下问题:
● 产次
● 出生胎龄
● 性别
● 生后喂养情况
● 家族史
● 是否使用过⼤环内酯类抗⽣素
CHPD的典型表现为出生后2~3周出现进行性加重的喷射性呕吐,以及严重梗阻引起的其他不良表现[4]。
典型病例为出生后2~3周开始呕吐,多在喂奶后半小时内出现,为间歇性出现,后逐渐加重,呈喷射性呕吐,次数逐渐增多,至每次奶后必吐。
因为梗阻位置在肠道总胆管开口之前,所以呕吐物不含胆汁,呕吐严重时可呈咖啡色。有时一次吐出量较一次进食量要多。患儿呕吐后仍有很强的食欲。
呕吐进行性加重后,入量不足,会出现脱水表现,并逐渐加重至营养不良。初期表现为体重不增,后体重迅速下降,皮下脂肪减少,皮肤松弛、干燥、弹性消失,前囟及眼窝凹陷,颊部脂肪消失。
由于长期呕吐,丢失了大量胃酸和钾离子,导致低氯、低钾性碱中毒,可表现为呼吸浅慢。
由于血中游离钙下降,还可以出现手足搐搦、喉痉挛等。
出现高胆红素血症的临床表现,如:巩膜及皮肤黄染。
高胆红素血症是CHPS最常⻅的临床相关疾病之⼀,⼀项研究中,14%的CHPS病例存在高胆红素血症[13,14]。通常以非结合胆红素升高为主,手术干预后不久便会缓解。
出现高胆红素血症的临床表现的原因可能与能量不足、脱水、酸中毒影响肝细胞的葡萄糖醛酰转移酶活力,以及大便排出延迟增加肠肝循环有关[13]。
CHPS患儿腹部体征具有特征性,可作为初步诊断的依据,因此腹部的视诊和触诊十分重要。
应在婴⼉安静、空腹时检查,以避免腹肌紧张产生干扰。呕吐后立即检查,此时包块不太可能被扩张的胃窦掩盖。要仔细耐心反复检查,用中指轻轻向深部触摸。要触摸深部位置时,可将左手放于患儿背后将腹部向上托起,右手将肝缘向上推移后,再向深部触摸。
可见到典型的体征为胃蠕动波和腹部肿物。
绝大多数患儿上腹部可见胃蠕动波,起自左肋下,向右上腹移动,然后消失。有时用手轻拍腹壁也可引起胃蠕动波的出现[4]。
右上腹腹直肌外侧缘可触及的坚硬包块,⼤⼩和形状类似于橄榄,表面光滑,硬度如软骨,即肥厚的幽门[4]。
若未触及肿块,诊断不明确时,可完善影像学检查协助诊断。⼀般来说,有幽⻔狭窄典型临床表现的患⼉首选超声检查。
其他的常规检查可评估患儿病情严重程度及有无并发症,如血常规、肝肾功能、电解质及血气分析。
超声检查的敏感性较高,可作为诊断CHPS的首选检查。
幽门管延长(≥16mm),幽门壁增厚(≥4mm),幽门直径10~14mm[4,15]。
幽门肌显示低密度回声,相应黏膜层显示高密度回声。
有助于确诊存在CHPS。
CHPS患儿频繁呕吐可能导致脱水,甚至血液浓缩。
不同程度的红细胞、白细胞、血小板按比例增加。
血液浓缩提示脱水。
CHPS患儿呕吐后丢失大量钾离子、氯离子。
血氯、血钾水平降低。
提示
CHPS患儿长期呕吐,导致丢失大量胃酸。
PH>7.45。
提示碱中毒。
CHPS可能会影响肝细胞的葡萄糖醛酰转移酶活力,以及增加肠肝循。
非结合胆红素升高,肝酶水平正常。
提示存在并发症-高胆红素血症。
CHPS所致的严重脱水可能会导致肾前性氮质血症。
肌酐、尿素氮升高。
提示肾功能不全。
如果患⼉有胆汁性呕吐或有其他特征提示更远端梗阻,还需完善上消化道造影检查[16]。
CHPS的特征性表现为:
(1)胃扩大、胃蠕动增加。
(2)胃排空时间延长,12~24小时胃内仍有造影剂潴留。
(3)幽门管窄长如线状,向头侧弯曲,呈“线样”征,或呈“鸟嘴”征。
(4)钡剂沿幽⻔管形成两条细轨道(“双轨”征,由压缩的幽⻔黏膜所致)。
(5)肥厚的幽⻔肌压迫胃窦呈环形压迹(“肩”征)。
如上消化道造影出现以上特征性表现,提示存在幽门肌肥厚及幽门梗阻。
影像学检查仍不能确诊时,或因症状和体征不典型而需要评估其他消化道疾病时,可行上消化道内镜检查。
可见幽门黏膜聚集、管腔狭窄,内镜无法通过或通过困难。
如上消化道内镜检查出现以上特征性表现,提示存在幽门肌肥厚及幽门梗阻。
CHPS的诊断主要依据典型的临床表现,呕吐、胃蠕动波、右上腹橄榄状肿块即可初步诊断。如未触及肿块,影像学检查是辅助诊断的重要手段。
(一)临床诊断
临床表现:婴儿出现上⽂所述的提示性特征,右上腹触及橄榄样包块即可诊断。
(二)确诊标准
腹部超声、上消化道造影出现上文所述的特征,参见“辅助检查”章节可确诊[3]。
因呕吐物不含胆汁,可排除高位不完全性肠梗阻,如肠扭转。在右上腹不能触及肿块时应与以下情况相鉴别:幽门痉挛、胃食管反流、胃扭转、肾上腺危象以及喂养不当[1,4]。
临床症状相似,多在生后即出现间歇性不规则呕吐,非喷射性,量不多,无进行性加重,也无营养不良、脱水等表现。右上腹触不到包块。用阿托品治疗效果良好,可使呕吐消失。
X线检查仅有轻度幽门梗阻的改变,但无典型幽门狭窄的影像。
常常为生理性反流,非喷射性呕吐,腹部未触及包块,患儿其他方面健康,不伴有电解质异常、体重减轻等表现。采用前倾俯卧位和稠厚食物喂养可使呕吐减轻。
食管钡餐、食管测压及PH监测有助诊断。
生后或数周出现呕吐,多在喂奶后,移动体位时呕吐加剧,腹部无阳性体征。
钡餐造影可明确诊断。
X线钡餐见:双胃泡、双液平面、胃大弯位于胃小弯之上,幽门窦高于十二指肠球、食管与胃黏膜有交叉现象等典型征象。
肾上腺功能不全的新生⼉可能出现肾上腺危象,表现为呕吐和脱水,低血压和高血钾性酸中毒是其特征表现,与CHPS不同。
女婴肾上腺功能不全可能有外生殖器男性化或性别不清[17]。
电解质检查可见血钾升高;血气分析提示PH降低。
生后几天内出现呕吐,呕吐为非喷射性,吐量不多,但呕吐与体位关系较明显,喂奶后将患儿平放易吐,保持竖立位即可防止。腹部无阳性体征。
钡餐造影可见钡剂从胃向食管反流,食管与胃连接部移向胸腔。
幽门前瓣膜是较少见的先天发育畸形。无孔隔膜患儿生后即出现完全梗阻症状。隔膜孔较大者可无症状。隔膜孔较小者在新生儿期即可发病,主要症状为呕吐,食后即吐,常呈喷射状,呕吐物为奶汁,无胆汁。可见胃蠕动波,但触不到肿物。
本病对解痉剂治疗无效,必须手术切除隔膜。
钡餐造影可见胃大小正常,幽门前1-2cm处狭窄缺陷,钡剂可通过隔膜孔,无幽门管延长、弯曲、十二指肠球压迹等肥厚性幽门狭窄特点。
喂养方式不当或吃奶过快而引起呕吐,无阳性体征,经抱起患儿拍背、调整喂养方法有好转。
本病受遗传因素和环境因素影响,多见于第一胎,父或母有本病史者,出现典型呕吐表现或体征的男婴,需警惕此病,需及时就医。目前尚无可靠的产前诊断方法,故无明确的预防措施。
⼤多数患⼉在术后数⼩时内即可开始少量喂糖水,逐渐恢复喂养。术后患⼉大多会出现轻度反流,若不是⾮常严重或伴有其他症状,则无需特殊处理。术后剧烈呕吐罕⻅,不应因此推迟喂养[20]。若术后呕吐持续,应进行影像学检查,需要注意术后肿胀或手术切开不完全。
绝⼤多数患⼉通过幽门环肌切开术后治愈。因此术后如果不出现异常表现,只需接受常规⼉科保健,监测生长情况。
1. 加强营养,少量多次喂养,每次喂奶后抱起患儿拍背,监测生长发育情况。
2. 若患儿在院外出现呕吐,应立即将患儿头偏向一侧,并及时清楚口鼻分泌物,防止窒息。
3. 定期复查,如出现反复呕吐及时复查。
本站内容仅供医学专业人士参考
不能作为诊断及医疗依据,请谨慎参阅
©医知源 版权所有,未经许可,不得以任何形式对医知源内容和插图进行转载使用。



 长按文字
长按文字