


运动神经元病(motor neuron disease,MND)是一组病因未明的,选择性上、下运动神经元受损为突出表现的慢性进行性神经系统变性疾病,主要累及大脑皮质锥体体细胞、脑干运动神经核及脊髓前角运动神元。临床表现为上、下运动神经元损害的不同组合,特征表现为进行性肢体及球部的肌肉萎缩、无力,通常不伴有感觉及
MND为罕见病,于2019年纳入我国罕见病目录。该病发病率为2~4/10万[1],患病率为4~6/10万,年死亡率为2/10万,临床现表现为进行性病程,该病尚无有效的治疗手段,生存期通常为3~5年,少数可达10年以上,多数患者最终因呼吸衰竭而亡,少数患者在呼吸机等维持下可生存数十年以上。
MND临床表现异质性较高,临床症状多种多样,且尚特异的生物标记物,因此,详细的问诊及查体非常重要。
MND是一种无法治愈的疾病,但有许多方法可以改善患者的生活质量,应早期诊断,早期治疗,尽可能延长生存期。治疗中除了使用延缓病情发展的药物外,还包括营养管理、呼吸支持和心理治疗等综合治疗。
运动神经元病(motor neuron disease,MND)是一组病因未明,以选择性上、下运动神经元受损为突出表现的慢性进行性神经系统变性疾病,主要累及大脑皮质锥体细胞、脑干运动神经核及脊髓前角运动神经元[1]。临床主要表现为肌无力、肌萎缩、肌束纤颤和锥体束损害,通常不伴有感觉及
由于病损部位不同,MND可分为通常分为肌萎缩侧索硬化(amyotrophic lateral sclerosis,ALS)、进行性肌萎缩(progressive muscular atrophy,PMA)、进行性延髓麻痹(progressive bulbar palsy,PBP)和原发性侧索硬化(primary lateral sclerosis,PLS)4种临床类型[2]。
1. 肌萎缩侧索硬化(ALS)
是累及上运动神经元(UMN)和下运动神经元及其支配的躯干、四肢和头面部肌肉的一种慢性、进行性变性疾病。常表现为上、下运动神经元合并受损所致的进行性肌无力、肌萎缩、肌束颤动等,是MND中最常见的类型。
2. 进行性肌萎缩(PMA)
是一种罕见的、成年起病的神经退行性疾病。起病隐匿,大多数患者均先侵犯脊髓颈膨大的前角细胞,少数(10%)从腰膨大开始。
3. 进行性延髓麻痹(PBP)
是延髓和脑桥后组颅神经运动性神经核的变性疾病,是MND比较少见的一种类型,被认为是ALS的延髓变异型。
4. 原发性侧索硬化(PLS)
是一种进行性UMN变性为特征的疾病,临床较罕见。由于病变累及锥体束,导致患者出现双下肢肌张力增加、僵硬,行走呈现特殊的剪刀步态。多在中年以后发病,起病隐匿,病情进展慢,生存时间较长。
《肌萎缩侧索硬化诊断和治疗中国专家共识2022》指出,PMA可看作是下运动神经元起病的ALS,PBP则是延髓症状起病的ALS,临床诊断时可归类为ALS。另外,ALS的特殊类型还包括连枷臂综合征、连枷腿综合征以及ALS伴额颞叶
ALS为罕见病,于2019年纳入我国罕见病目录。欧洲及美国年发病率是2~3/10万,患病率为(3~5)/10万。中国ALS的流行病学数据主要来自香港地区,发病率约0.6/10万,患病率约3.1/10万[3]。目前该病尚无有效的治疗手段,生存期通常为3~5年,少数可达10年以上,多数患者最终因呼吸衰竭而亡。
目前全球关于PMA流行病学特征与疾病负担的研究比较缺乏,国内一项基于15省城镇医疗保险数据测算我国成人PMA患病率,结果显示2016年我国PMA患病率为0.28/10万人年,且存在地区差异,西南地区低,而西北地区高。该病男性患者多见,平均发病年龄为46.21岁[4]。
PBP发病年龄较晚,多在40~50岁以后起病,男性多于女性,患病后其平均存活期2~3年。该病进展较快,预后不良,多在1~3年内死于呼吸肌麻痹和肺感染。目前有学者提出孤立球麻痹概念(isolated bulbar palsy,IBP),被认为是一种罕见的ALS区域性变体,其进展似乎比典型的延髓起病的ALS慢。最近关于IBP的报告显示其发病率较低,估计为ALS的1%~4%。发病年龄略低于典型的延髓型ALS[5-8]。
MND的确切发病机制尚不清楚,目前有多种学说:遗传机制、兴奋性氨基酸毒性、氧化应激、神经营养因子障碍、自身免疫机制、病毒感染及环境因素等。目前较为统一的认识是在遗传背景基础上的氧化应激和兴奋性氨基酸毒性作用影响了线粒体及细胞骨架的结构和功能,从而导致了运动神经元损伤[9.10]。
1. 遗传因素
本病多数为散发,5%~10%呈遗传性,最常见的致病基因为铜(锌)超氧化物歧化酶(superoxide dismutase 1,SOD-1)基因,约20%家族性ALS和2%散发性ALS与此基因突变有关,多呈常染色体显性遗传和常染色体隐性遗传。SOD-1突变是该病的重要致病基因,2018年之前已经发现了超过180种包括点突变、无义突变、移码突变等多种突变体存在。经典的突变包括D90A、A4V以及G93A等。其中D90A突变虽然主要是以隐性致病的ALS致病基因存在,但也存在显性发病的情况;A4V突变则在美国ALS病患中较为常见,超过一半的美国SOD-1突变的ALS患者都是这种突变;G93A是国人最常见的致病性突变。
SOD-1突变导致ALS其分子机制有:①突变的SOD-1导致细胞的OS增加;②突变的SOD-1溶解性改变从而易于发生蛋白质沉积;③突变的SOD-1导致细胞内钙离子紊乱及毒性的扩散;④细胞质动力蛋白导致的轴突运输缺陷。另外,目前发现与家族性ALS相关的致病基因近30个,其中反式激活反应-DNA结合蛋白基因(TARDBP),肉瘤融合基因(FUS),9号染色体开放阅读框72(C9orf72)和SOD-1突变是亚洲患者主要的致病基因[11]。越来越多的文献提及了散发性ALS患者的基因突变,这也突显了基因突变在ALS中的作用。
2. 兴奋性氨基酸毒性
谷氨酸是中枢神经系统主要的兴奋性神经递质,谷氨酸诱导的兴奋性毒性在ALS的发病机制中已被证实。其与突触后膜上N-甲基-D-天冬氨酸(NMDA)受体和α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体的结合,谷氨酸与这些受体结合后,可以激活钙依赖性酶途径导致神经退行性变。谷氨酸还可诱导自由基产生和上调促炎介质导致神经退行性变。
3. 氧化应激
大量证据表明,活性氧(reactive oxygen species,ROS)产生过多是ALS的一个重要病理特征,OS与运动神经元的丢失和线粒体功能障碍有关。临床研究结果提示,ALS患者外周血中OS标记物8-羟基鸟苷、丙二醛和高级氧化蛋白产物水平显著升高,谷胱甘肽和尿酸水平降低,提示OS在ALS发病中发挥重要作用[12]。
ALS的早期临床表现多样,缺乏特异的生物学确诊指标。详细的病史、细致的查体和规范的

图1 首诊可疑患者鉴别流程
通过充分的辅助检查结果排他后,需要根据患者的症状、体征,尤其是神经电生理检查结果,进行分层诊断。对于可能的尚未达确诊标准的ALS患者,临床医生需要对患者每3个月进行随访,以期尽早明确诊断。
MND临床表现多样,且缺乏特异的生物学确诊指标,因此,详细的问诊及查体对于疾病的早期诊断非常重要。
(1)现病史
患者主诉通常为肌肉无力、萎缩,或表述为走路不稳、
(2)既往史
询问患者是否有脊髓灰质炎病史,
(3)个人史
需关注患者是否有冶游史,铝毒物接触史。
(4)家族史
家族史询问很关键,约10%患者为遗传性,有家族史的患者,需询问患者兄弟、姐妹、父母,祖父母的病史,对于明确家族史的患者,建议绘制家系调查图。
2. 症状
(1)PLS
通常隐匿起病,多数患者下肢先出现症状,少部分患者出现
随着疾病进展,患者可出现尿频、尿潴留,晚期可有小便失禁,通常无意识及智能改变。
(2)PMA
临床表现呈进行性下运动神经元损害的表现,表现为肌肉无力、萎缩,肉跳感,无UMN损害的表现。
(3)PBP
主要表现为进行性发音不清、声音嘶哑、
(4)PLS
病变常先侵犯下胸段皮质脊髓束,出现双下肢的UMN性瘫痪。若波及颈段皮质脊髓束,则双上肢也出现UMN性瘫痪,但少见。
通过详细的病史和体格检查,在脑干、颈、胸、腰骶4个区域中寻找上、下运动神经元共同受累的证据,是诊断ALS的基础。查体发现在同一区域,同时存在上、下运动神经元受累的体征是诊断ALS的要点。
下运动神经元受累体征主要包括肌肉无力、萎缩和肌束颤动。通常检查舌肌、面肌、咽喉肌、颈肌、四肢不同肌群、背肌和胸腹肌。上运动神经元受累体征主要包括病理征阳性、腱反射亢进、肌张力增高、阵挛等。检查包括吸吮反射、咽反射、下颌反射、掌颌反射,有无强哭、强笑等假性延髓麻痹表现,以及四肢腱反射、肌张力、霍夫曼征、下肢病理征、腹壁反射等。临床查体是发现上运动神经元受累的主要方法,在出现萎缩、无力的区域,如果腱反射不低或活跃,即使没有病理征,也可以提示锥体束受损。
1. 神经电生理检查
当临床考虑为ALS时,需要进行神经电生理检查,以确认受累区域为下运动神经元病变,并可发现未受累区域的下运动神经元病变,同时协助排除其他疾病。神经电生理检查可以看作是临床查体的延伸,应该由合格的
(1)神经传导测定
神经传导测定主要用来诊断或排除周围神经疾病。运动和感觉神经传导测定应至少包括上、下肢各2条神经[2]。
①运动神经传导测定:远端运动潜伏期和神经传导速度通常正常,无运动神经部分传导阻滞或异常波形离散。随病情发展,复合肌肉动作电位波幅可明显下降,传导速度也可轻微减慢。
②感觉神经传导测定:存在嵌压性周围神经病或同时存在其他的周围神经病时,传导会异常。在进行下肢的感觉神经传导测定时,有些老年患者很难引出感觉神经动作电位,并不一定是异常。
③F波测定:通常正常。当肌肉明显萎缩时,相应神经可见F波出现率下降,而传导速度相对正常[13]。
(2)同芯针
下运动神经元病变的判断主要通过同芯针
①进行性失神经表现:主要包括纤颤电位、正锐波和束颤电位。当同时存在慢性失神经的表现时,束颤电位与纤颤电位、正锐波具有同等临床意义。
②慢性失神经的表现:运动单位电位的时限增宽、波幅增高,通常伴有多相波增多;大力收缩时运动单位募集相减少,发放频率升高,当同时存在UMN受累的体征时,发放频率的测定会受到影响;大部分ALS可见发放不稳定、波形复杂的运动单位电位[2]。
当
2. 核磁共振
由于该病常发生在50岁以上患者,疾病进展缓慢,早期诊断困难,按照常见病的思维,需要根据患者症状、体征完善头、颈、胸、腰椎核磁排除颈椎、胸椎、腰椎疾病及
3. 脑脊液检查
腰椎穿刺脑脊液检查可完善细胞学、生化及免疫学等检查,包括细胞计数,总蛋白浓度,葡萄糖,乳酸,蛋白电泳,包括IgG指数,副肿瘤相关抗体,神经节苷脂抗体。
1. 基因检测
自20世纪90年代以来,已发现SOD1、ANG、VAPB、VCP、SQSTM1、TARDBP、DCTN1、DAO、SETX、FUS、C9ORF72、ATXN2、OPTN、 SCFD1、NEK1、C21ORF2 等 20 多个基因突变。
建议充分、详细询问ALS患者及其兄弟姐妹的病史以及患者父母、祖父母的详细病史和其兄弟姐妹的病史。具有家族史的患者中,可选择二代测序进行基因检测,需重点关注SOD1、C9orf72,TARDBP、FUS等基因致病性的改变,以明确遗传性运动神经元病的病因。尚需关注雄激素受体基因的改变,与肯尼迪病进行鉴别;对于单纯上运动神经元损害的患者,需关注SPG3A、SPG4、SPG6、SPG7和SPG20基因突变情况,以与
2. 功能影像检查
功能磁共振、大脑运动皮质厚度分析、磁共振波谱成像、锥体束弥散张量成像等技术,作为生物学标志物,可反映UMN受累的表现,有可能在随诊中有一定作用,但仍处于研究阶段,尚无法用于临床诊断[2]。
1. ALS
目前,国际公认的ALS诊断标准有以下几种,分别为EI Escorial诊断标准、Airlie House诊断标准(又称修订版El Escorial诊断标准)和Awaji-shima电生理诊断标准,以及2015年修订版El Escorial诊断标准[3]。
表1 ALS诊断核心标准、支持标准及排除标准
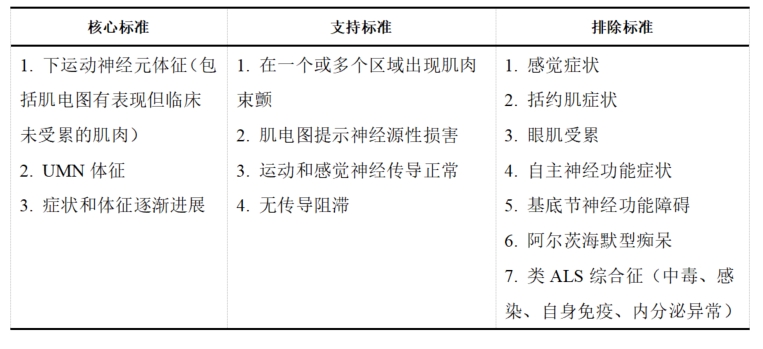
注:UMN 上运动神经元
ALS诊断在早期依据临床、电生理检查及基因检测的证据进行分级诊断,为了更早期对ALS进行诊断,2020年ALS黄金海岸电生理诊断标准提出了新的建议[20]。关于ALS的诊断要点及注意问题,《肌萎缩侧索硬化诊断和治疗中国专家共识2022》也给出了相应指导[2]。
2. PMA
PMA诊断主要依据临床表现和电生理改变发现2个或以上不同节段神经支配的下运动神经元病变的症状和体征,同时排除其他导致下运动神经元损害综合征方可确诊。
3. PLS
目前关于PLS及与以UMN为主的ALS重叠临床诊断的不准确性,已成为PLS治疗发展的障碍。2020年国际PLS专家会议工作组制定更宽松的诊断标准,以促进PLS治疗的发展诊断标准[21]。该诊断标准见表2。
表2 PLS的诊断标准
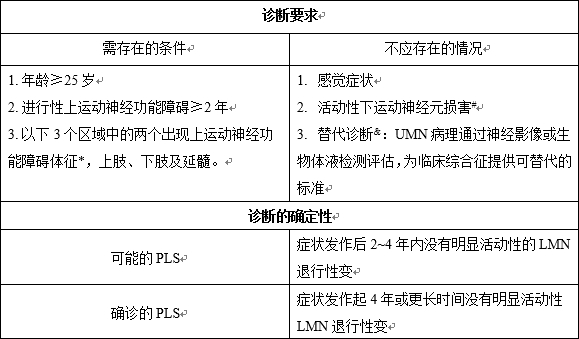
注:*:临床体征包括痉挛及相关的无力、病理性反射亢进、假性球麻痹;新的神经影像学、神经电生理和神经化学生等实验室物标志物作为UMN功能障碍的依据据(目前还正在等待验证)。
#:允许四肢出现极少量的插入电位、正锐波或纤颤电位
&:基因检测;纯UMN损害少见的基因变异不作为常规筛查(如SPG7*
ALS2*,D4S2963*,C9orf72,DCTN1,PARK2,ERLIN2,FIG4,SYNE2,VEGFA,CLN6,BTD,LRKK2,SQSTM1*,KIF5a*,KIF1a)
该病常见的并发症多出现于疾病的晚期阶段,例如,患者因吞咽功能障碍误吸可导致
该病隐袭起病、缓慢进展,无特异诊断性生物学标志物,需要与肯尼迪病、脊髓灰质炎后综合征、
易误诊人群
MND多发生于中老年患者时,早期症状轻微,容易误诊为
本病被误诊为其他疾病
该病在临床中易被误诊为脊髓型
其他疾病被误诊为本病
其他容易误诊为本病者包括临床上需要鉴别的疾病,如平山病、肯尼迪病、
目前尚无具体预防措施。
康复治疗可能延缓患者机体功能的下降,临床上可依据患者症状及耐受程度,选择适合患者的康复治疗措施。康复的干预方法包括物理治疗、作业治疗、言语治疗、心理治疗、假肢矫形器治疗等,具体方案可参照康复科医生专业的建议。
该病患者在早期拟诊阶段需要每3个月复查
患者可能因误吸合并感染,需根据感染可能的致病菌给予抗感染治疗,并留取
对于诊断明确的患者,要积极面对疾病,保持良好心态,家属给予患者足够的关爱,保证患者与疾病抗争的决心。
对患者的建议如下:
①避免使用安定类镇静药物。
②营养供应,避免使用味素、鸡精,尽量少使用含有谷氨酸钠、谷氨酸钾食物。
③建议适当进行功能锻炼,延缓病情进展,根据患者自身情况制定运动计划,以运动后不感到疲劳、易于恢复为度,运动强度可根据自身运动能力缓慢增加,切勿过度运动。
④定期监测呼吸功能,尽早使用无创呼吸机。
⑤对于长时间卧床者,应经常帮助其进行翻身,防止褥疮。
本站内容仅供医学专业人士参考
不能作为诊断及医疗依据,请谨慎参阅
©医知源 版权所有,未经许可,不得以任何形式对医知源内容和插图进行转载使用。



 长按文字
长按文字