
川崎病(kawasaki disease,KD),又称皮肤黏膜淋巴结综合征,是一种病因未明的急性系统性血管炎,多发于5岁以下儿童[1]。
发病机制与免疫细胞异常活化(B淋巴细胞异常活化)、核转录因子κB活性增强,细胞因子大量表达与释放、全身血管炎(血管内皮细胞功能紊乱)等密切相关[2, 3]。KD的主要临床表现为急性或持续性
阿司匹林和免疫球蛋白(intravenous immune globulin,IVIG)是KD的主要治疗药物,临床上大部分患儿在接受足量(2g/kg)IVIG治疗之后体温恢复至正常,其他临床症状也逐渐消退,但仍有10%~20%的KD患儿在应用足量 IVIG 36h后仍持续
KD目前不再被认为是一种自限性疾病,并且它可引发较为严重的心血管并发症,必须早期诊断并加以治疗,以保障患儿的生命健康。
川崎病(kawasaki disease,KD)又称皮肤黏膜淋巴结综合征,是一种病因未明的,以
根据临床表现是否完全符合KD诊断标准,可分为完全性KD(complete kawasaki disease,cKD)和不完全性KD(incomplete kawasaki disease, iKD)两种类型[6]。
KD为临床综合征,诊断主要依靠临床表现,在排除其他疾病后,若患儿临床特征符合指南诊断条目数的5~6项以及4项主要临床特征且合并冠状动脉异常的患儿,则诊断为cKD[7, 8]。
其主要症状除
● 双侧球结膜充血。
● 唇红,杨梅舌,口咽部黏膜弥漫性充血等口唇及口腔的变化。
●
● 急性期手足发红、末端硬性
● 非化脓性颈部淋巴结肿大。
患儿
KD于1967年由日本 Tomisaku Kawasaki教授首次报道[9],随后人们对KD的认识及诊疗水平逐步提高,但遗憾的是,近60余年的研究和调查并未能阐明KD的病因,目前KD的全球发病率仍在上升[8]。
KD发病具有明显的年龄特征,5岁以下儿童占80%以上,10岁以上发病者较少见,发病年龄中位数为1.7~2.5岁,性别以男孩多见,男女之比为1.5:1~1.8:1,且有一定的复发可能,复发率为1%~3% [1]。
● 在未经治疗的KD儿童中,高达25%可能发生冠状动脉病变,导致严重的并发症,如
● 在KD并发症方面,我国上海市的资料显示[11],随着人们对KD认识的加深和诊治的及时,患有心脏并发症的KD患者比例下降,但存在严重冠状动脉瘤的患儿构成比仍高。
最新流行病学资料显示,日本仍是KD发病率最高的国家,据统计2018年日本KD发病率为359/10万(≤4岁的儿童),较5年前上升了1.2 倍[12]。
中国缺乏KD总体发病率的统计,根据各省市多中心流行病学资料估算,在<4岁儿童群体中,中国KD发病率大于100/10万[6, 13]。
得益于早期IVIG的应用以及综合治疗水平的提高,KD病死率已经明显下降。
20世纪90年代,日本KD病死率为0.03%。我国上海市资料显示,1998至2007年KD的病死率为0.26%,2008至2012年为0.09%,2013至2017年无死亡病例[14]。
病死率的不断降低与KD及其并发症的早期诊断、规范化治疗以及管理具有密切关系[6]。
因KD治疗方案的特殊性,KD治疗费用较大,根据一项多中心研究统计KD患儿住院总费用平均为9962~16808元[15]。
迄今为止,KD的病因尚不明确,可能是多因素共同作用而诱发的一种异常免疫反应,根据目前的一些观察及研究发现,主要与感染因素、环境因素、免疫失调和遗传因素等密切相关[2]。
目前KD发病机制仍未明确,根据目前的研究认为其发病机制与机体内免疫细胞异常活化(B细胞异常活化)、细胞因子大量表达、核转录因子κB活性增强、全身血管炎(血管内皮功能紊乱)等密切相关。
主要受KD急性期调节性T细胞(Treg)的抑制。
Treg调节细胞,可通过调节靶向T细胞以及抗原呈递细胞以抑制T细胞增殖和细胞因子产生,同时可以产生具有强抗免疫特性的抑制性细胞因子,亦可抑制细胞。
多项研究表明,KD患者外周血循环中FOXP3 表达下调,Treg细胞功能受损,Treg细胞数量减少,Treg细胞数量以及功能的变化已被证实在KD的发生发展中起重要作用[2]。
KD患儿体内异常活化的炎症细胞诱导产生大量的炎性细胞因子,并且相关研究已证实炎性细胞因子表达上调在KD的发生发展中产生着至关重要的作用。研究发现,急性期KD患儿血清IL-6水平显著升高,经IVIG治疗后血清IL-6水平恢复至正常,且血清IL-6水平与红细胞沉降率和C反应蛋白均呈正相关;与IVIG应答者相比,IVIG无应答者的血清IL-6水平显著升高;并且此类炎性细胞因子水平与机体内其他器官损伤程度呈正相关[16, 17]。
细胞外基质的重构是KD血管病变的一个重要组织学特征,由细胞外基质分子构成的基底膜为血管系统提供了结构支撑。
基质金属蛋白酶(matrix metalloproteinases,MMPs)是由内皮细胞、单核/巨噬细胞以及中性粒细胞等合成分泌的蛋白酶,可降解细胞外基质,而保持细胞外基质完整性的关键是MMPs与金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinases,TIMPs) 之间的动态平衡。
单核细胞以及中性粒细胞在向血管内皮细胞迁移、黏附过程中可诱导产生大量MMPs和炎性细胞因子,导致MMP-9表达水平升高,导致血管屏障功能破坏、炎症细胞及炎性细胞因子浸润血管壁,进一步加剧血管炎症损伤[1]。
KD的显著特征是免疫系统高度活化以及免疫损伤性血管炎。血管内皮生长因子(VEGF)作为一种多功能调节剂,参与血管形成、内皮细胞增殖和存活、有丝分裂及改变血管通透性。在KD的急性期及非急性期均发现VEGF水平的升高,而且KD合并冠脉病变(coronary artery lesions,CAL)的患儿血中VEGF水平较无CAL患儿显著升高。研究发现在KD发病进程中,VEGF与内皮抑素的平衡状态被打破,VEGF/内皮抑素的比值明显增高,而且这种改变可能与KD患儿急性期CAL有极大的关联[18]。
在许多的KD死亡者的病理解剖和疾病动物模型中,发现大量活化的免疫细胞存在于KD冠状动脉病变部位,中性粒细胞多存在于炎症发生的早期阶段,继而是巨噬细胞、树突状细胞,随后以浆细胞以及T细胞的活化为主的特异性免疫也被激活,在KD患者冠状动脉病变浸润中也存在T淋巴细胞,且在动物模型内发现,冠状动脉炎症病变时是T淋巴细胞起主要作用而不是B淋巴细胞[19]。
KD为系统性的血管炎,好发于冠状动脉,以冠脉损伤为例,其病理改变可分为以下几期:
(一)第一期
发生于约1~9天,表现为小动脉周围急性炎症变化,主要侵犯冠脉分支血管壁上的小营养动脉和静脉,心包、心内膜及冠状动脉分支等被中性粒细胞、淋巴细胞以及嗜酸性粒细胞浸润,但并未浸润全层。
(二)第二期
发生于12~25天,冠状动脉血管内皮
(三)第三期
发生于28~31天,此期动脉急性炎症逐渐消退,纤维组织增生,血栓和肉芽形成,内膜显著增厚,可导致冠状动脉部分或完全阻塞,部分患儿会出现
(四)第四期
病变逐渐愈合,心肌瘢痕形成,阻塞的动脉可再通,发生于数月至数年后。
(一)筛查人群
一旦5岁以下儿童出现
KD诊断主要依靠临床表现,在排除其他疾病后,若患儿临床特征符合指南诊断条目数的5~6项以及4项主要临床特征且合并冠状动脉异常的患儿,可诊断为cKD。
若患儿
当CRP<30mg/L和ESR<40mm/1h,如果
(二)筛查手段
常用的筛查手段包括血常规、血沉、肝肾功能、心功能、细胞因子、血浆脑钠肽(B‑type natriuretic peptide,BNP)或 N 端 脑 钠 肽 前 体(N‑terminal pro‑B‑type natriuretic peptide,NT‑proBNP)、
KD为临床综合征,诊断主要依靠临床表现并结合实验室检查,并排除其他疾病。
根据临床症状,并结合相关指南[7,20],cKD与iKD的诊断流程大致如下:
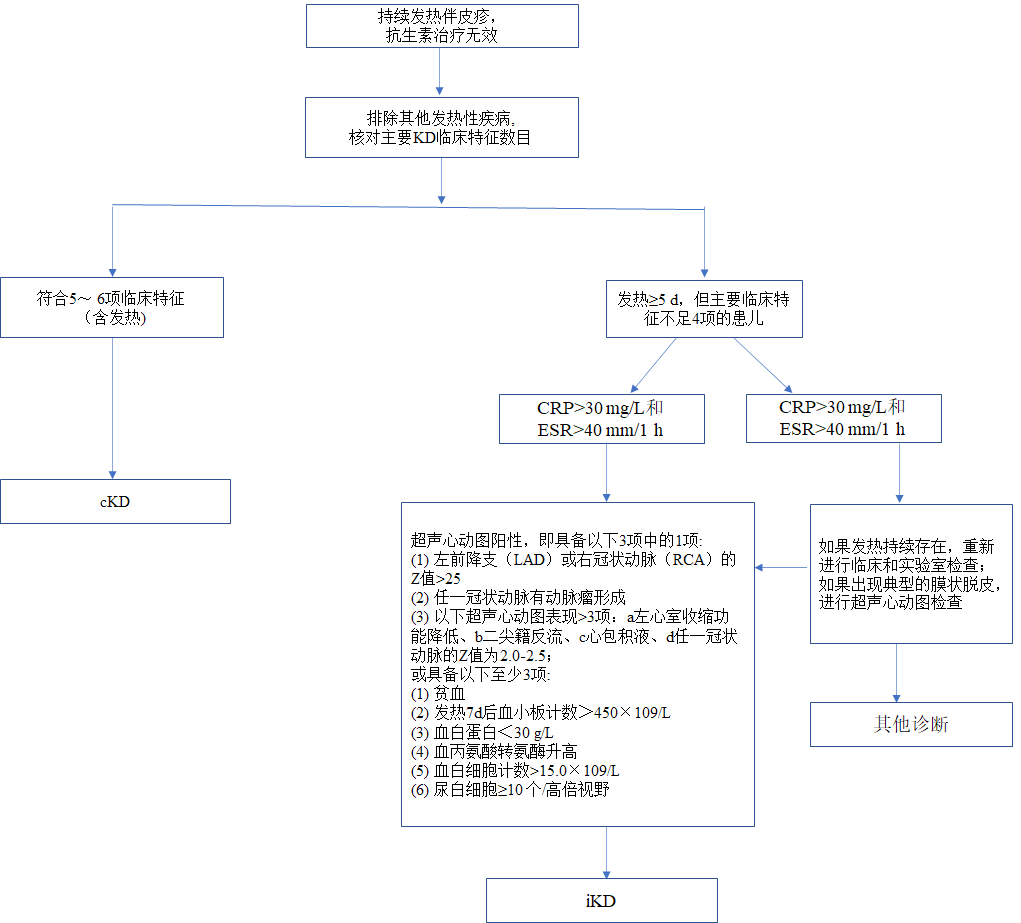
图1 KD诊断流程
KD为系统性血管炎,存在多系统损伤,可以某些特定脏器损伤为首发症状,有时会被误诊为其他疾病[21],如尿路感染、化脓性淋巴结炎或腮腺炎、急腹症、肝炎、关节炎等。因此,在问诊过程中要注重诊断标准相关症状的询问。
查体时应对患儿的双侧结膜、唇、舌、口腔黏膜的改变、四肢末梢的改变、躯干
另外,KD的典型症状在一个患儿病程中并非同时出现,来诊时可能只有部分表现,在治疗观察中又出现其他症状和体征,上述症状也可以在不同的病例以不同的组合存在。比如较为典型的在查体时多形性
对于临床医生而言,迅速识别及诊断KD仍然是一项挑战,临床上随着对该病认识的不断深入,一些不完全符合KD诊断标准的病例越来越多,特别是以损害某一脏器为首发表现的更容易误诊[4]。
因此在问诊时应注意:
● 对于
● 对
● 应全面系统分析病例,避免只专注于局部症状。在考虑某单一疾病时,但病史存在不符诊断之处,此时应认真重新考虑诊断问题,避免只重视局部症状,忽略全面分析造成误诊。
大量文献表明感染因素参与了KD的发病,病原体包括细菌、病毒以及其他微生物,多数研究认为,患儿被病原体感染之后机体会产生一系列级联免疫反应,这些在发生感染的同时激发人体免疫系统的病原微生物很大程度上是在扮演催化剂的角色[22]。
另有相关文献指出,环境因素与KD的发病同样密切相关,环境因素也可能是KD产生的一个重要诱因[23]。
KD为一种临床综合征,临床特征由全身多系统血管炎引起,症状多样而无明显特异性,根据临床经验分为主要临床特征和其他临床表现。
(一)主要临床特征
①
(二)全身其他系统表现
KD为系统性血管炎,除了以上6项主要临床特征外,还可有其他全身各个系统表现。
● 常为反复
● 1周内
可有
● 呕吐、
● 肝炎、
关节红肿、关节痛,可累及大小关节(滑膜液细胞数增多),可持续较长时间。
● 易激惹。
●
● 面神经麻痹等疾病相关症状,如鼻唇沟变浅、口角歪斜、病灶对侧的面部随意动作丧失、听力等。
● 感音神经性耳聋相关症状,如:听力下降、
无菌性脓尿,泌尿道或尿道口炎,鞘膜积液等相关症状,如:尿频、尿急、尿痛等。
因为目前KD 的病因及机制尚未明确,但根据KD的流行病学调查认为前驱感染、年龄(<5岁)、性别(男性)、遗传等是产生KD的重要危险因素[24]。
KD主要依靠临床特征并结合全身多系统血管炎的表现及实验室检查进行临床诊断,缺乏金标准,故在对怀疑KD患儿进行查体时,应对患儿进行全面仔细的视、触、叩、听查体,特别是应针对KD诊断标准中的主要临床症状进行检查,并在查体过程中排除其他疾病可能。
对KD患儿的视诊,主要观察其双眼球结膜、口腔、皮肤等改变。
在KD诊断中主要依靠6个主要特征,而这6个主要临床特征多以视诊进行鉴别,因KD可累及多个器官系统,故在相应器官受到侵犯时可依靠叩诊、触诊及听诊检查到相应体征。
指两侧眼球结膜(典型部位在虹膜周围的无血管区)出现非渗出性充血,不伴疼痛和畏光,无
裂隙灯下可观察到轻度急性虹膜睫状体炎(前葡萄膜炎)。
口唇红、干燥、皲裂、脱皮以及出血,杨梅舌,口咽黏膜弥漫性充血等,伴或不伴咽扁桃体的渗出性改变及口腔溃疡。
通常在
亚急性期也可出现新发过敏性皮炎。水疱性
卡疤红肿是指原卡介苗接种处出现急性炎症,是KD的一项相对特异的早期表现,目前认为,即使没有全身其他
在急性期可见手掌及足底的硬性
从指甲或趾甲开始的脱皮多发生于起病2~3周之后,脱皮可扩展至整个手掌或足底呈“手套”或“袜套”样。
颈淋巴结肿大多为单侧无痛性,其直径大于1.5 cm,不伴有红肿及波动感。
目前为止,KD的诊断依然是排除性临床诊断,特别是iKD患儿临床症状和体征较少,此时较为针对性的辅助检查就显得极为重要。
对于疑似KD患儿,应优先完善相关实验室检查及
为非特异性指标。
白细胞计数升高,以中性粒细胞为主;血红蛋白降低;通常在病程第2周出现血小板计数增多,第3周达到高峰,4~6周恢复至正常;少数患儿可出现血小板计数降低,多提示病情严重,如并发巨噬细胞活化综合征。
仅提示患儿存在系统性炎症。
为非特异性指标。
白细胞增多但
提示患儿存在泌尿道炎症。
为非特异性指标。
不是KD的特异性诊断指标,结合患儿病史,可考虑KD诊断。
为非特异性指标。
血生化示转氨酶升高,总胆红素升高,肌酸肌酶及心肌同工酶升高,白蛋白和血钠降低等。
不是KD的特异性诊断指标,结合患儿病史,可考虑KD诊断。
为非特异性指标。
血清炎性细胞因子如白细胞介素6 、降钙素原轻、中度升高等。
仅提示患儿存在系统性炎症。
为非特异性指标。
血浆脑钠肽或N端脑钠肽前体升高,血清铁蛋白、血浆二聚体升高等。
BNP的升高在KD与其他
对于疑似KD的患者必须尽早进行
但同时应该强调
最新的日本KD诊断指南第6次修订版认为[20],冠状动脉内径Z值可以客观地反映病变情况,新版指南建议采用Z值来定义
当冠状动脉内径Z值≥2.5时,称为
若在急性期伴有以下异常情况有助于KD的早期诊断:冠状动脉管壁厚度增加、左室心肌节段运动异常、瓣膜反流、少量或者中等量的心包积液等。
若急性期未发现冠状动脉异常者可在起病后8周进行复查,但是对于高危患儿(持续
KD常累及多个器官系统,完善如下相关检查有助于了解患儿病情进展。
对怀疑心肌损伤的KD患儿,再完善心电图检查。
可发现心电图改变为:心律失常、P-R间期延长、非特异性ST-T改变以及QRS低电压等。
可明确心电活动改变及心机损伤情况等。
具有安全、无创、可重复、动态、实时等临床优点。
其他部位的超声检查,如部分患儿腹部超声显示肝脏肿大、胆囊壁
可明确患儿脏器、淋巴结及血管瘤等病情。
非KD常规检查手段,对于疑诊多个中型冠状动脉瘤或巨大冠状动脉瘤者,可行冠状动脉造影评估冠状动脉病变程度。
由于在KD急性期进行心导管检查会给患者带来一定影响,所以不建议患儿在病程2个月内进行冠状动脉造影。
如果心肌缺血是在随访期间出现的,则可以应用此种检查方式对患儿进行有效的诊断。
部分患儿可见冠状动脉瘤,及其分支改变。
该检查主要应用于疾病的恢复时期,对冠状动脉病变的形态和程度可进行有效评估,并在保证方案有效的基础上,对其展开治疗。
为KD非常规检测手段。
可显示冠状动脉瘤、冠脉血栓及其分支管腔闭塞、扩张等状态。
对于怀疑患儿可能发生巨大冠状动脉瘤合并血栓形成、栓塞等情况时,具有一定优势,或者当患儿在急性期的超声、心电图显示其已经出现了栓塞,则可应用多层螺旋CT检查进行协助判断。
2020年日本循环学会科学委员会第6次修订KD诊断指南[20](以下简称新版指南),但在2022年1月份发表的《川崎病诊断和急性期治疗专家共识》[7]中KD的诊断标准与之前一致,并未参照新版指南相关内容对KD的诊断标准进行修改。本文主要介绍新版指南诊断标准的相关内容。目前KD尚无特异性实验室诊断指标,cKD或iKD现行的确诊手段依然是排除性临床诊断,在排除其他
KD的经典定义要求
新版指南的制定基于主要临床特征数目以及是否存在冠状动脉异常(见表2)。符合“a”或“b”标准可诊断为cKD;存在3项主要临床特征,
表1 KD主要临床特征[18]
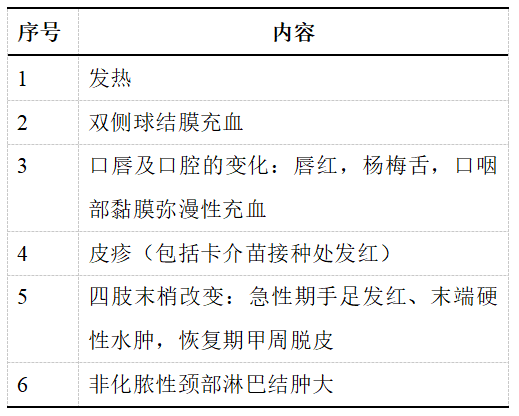
表2 cKD或iKD的诊断标准[18]
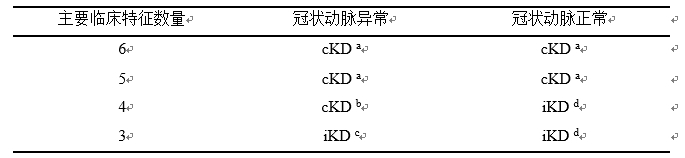
注:要诊断cKD或者iKD,需要排除其他
少数KD患儿可变为重症,如KD休克综合征(kawasaki disease shock syndrome,KDSS)和KD合并巨噬细胞活化综合征(macrophage activation syndrome,MAS)。重症KD患儿常存在血流动力学不稳定,可危及生命,需要早识别及早治疗。
(一)KDSS
KDSS的发生率约为7%[25],其发生机制尚不明确,几乎所有的KDSS患儿均具有明显的
(二)KD合并MAS
KD合并MAS的报道较少,发生率为1.1%~1.9%,较常见于5岁以上的患儿,属继发性噬血细胞性淋巴组织细胞增生症的特殊类型,可发生于KD的急性期、亚急性期或者恢复期,病死率达到13%[26]。
目前没有专门的KD合并MAS的诊断标准,若KD患儿血清铁蛋白进行性升高,合并以下2项或2项以上,需考虑合并MAS:
● 血小板计数急剧下降。
● 天冬氨酸转氨酶高于基线值数倍。
● 甘油三酯急剧增高。
● 纤维蛋白原明显下降。
● 骨髓或者其他组织(淋巴结、肝脏、脾脏等)发现噬血细胞。
(一)心血管并发症
是KD死亡的主要原因[27],如二尖瓣反流、迁延性心肌功能不全、冠状动脉病变、心功能衰竭、休克,因此及时准确识别并积极处理非常重要。冠状动脉病变(coronary artery lesions,CAL)是KD重要的并发症,主要表现为
(二)其他系统的并发症
因KD为全身血管炎性改变,也会出现其他系统的并发症,除上述提到的KDSS、MAS和CAL,还有以下几种:
1. 心肌收缩力减低
可以由于
2. 体循环动脉病变
KD最常见的并发症是冠状动脉瘤,由于其是一种以全身血管炎为主要病理改变的疾病,故可累及动脉、静脉和毛细血管,体循环动脉也有发生动脉瘤及狭窄的可能,但其罕见,也少有报道。体循环动脉瘤如未合并血栓无需进行特殊治疗,可应用IVIG,并长期口服阿司匹林抗炎以及双嘧达莫进行抗血小板治疗。多数体循环动脉瘤可在2~3年内回缩,预后较好。
3. 泌尿系统及肾脏病变
在KD的并发症中很少见。在已报道的病例中,这些并发症主要包括中度
4. 呼吸系统病变
可引起肺炎等病理变化,可能与其症状不显著而被忽略有关。
5. 消化系统病变
引起消化系统中胰腺、大肠、小肠、肠系膜等一系列病理变化。
6. 皮肤病变
7. 神经系统病变
有报道KD伴有感音神经性耳聋、颅神经炎症等。
KD临床症状不典型,常需与以下疾病进行鉴别诊断。
多有流行病学史,口腔内可见颊黏膜
血常规结果显示白细胞计数降低而淋巴细胞增高,CRP、SAA、ESR常不高或者轻度升高,
KD亦可出现
病毒感染后临床症状与部分KD患儿表现较为一致,病史及体征较难鉴别,但两者在实验室检查中存在一些差异。
病毒感染血常规白细胞计数不高或者降低而淋巴细胞计数增高,CRP、SAA、ESR常升高不明显,血液中病毒抗体可显著升高。
该病需要与KDSS进行鉴别,尤其是抗生素治疗无效时,需密切观察KD除
细菌性病原体较少累及患儿冠脉,进行
该类疾病有应用敏感药物病史,通常黏膜表现更严重,而且眼部症状不单纯是结膜充血,常表现为卡他性、化脓性以及假膜性结膜炎,可遗留眼部的并发症。
疾病早期两者实验室检查较为一致,若临床诊断不明确应及时行
该病主要表现为
必要时应行
此类微生物感染常见为
疾病早期两者实验室检查时,若出现肝肾功能、心功能异常,行
临床表现常缺乏特异性,可累及多个系统,主要表现为长期反复
部分布鲁氏杆菌病患儿合并动脉炎,完善心脏彩色多普勒超声检查可提示左前降支呈瘤样扩张,双冠状动脉主干内径扩张,内膜毛糙,极易误诊为KD合并冠状动脉瘤,但该病经IVIG冲击等治疗后体温无明显改善,
临床症状类似于KD,但组织细胞坏死性淋巴结炎以高热、淋巴结增大症状较突出。
实验室检查以血白细胞计数降低,淋巴细胞计数升高为主,而KD血白细胞计数及中性粒细胞计数升高显著,组织细胞坏死性淋巴结炎最终诊断需借助组织病理学检查。
儿童MIS-C最常见于年幼的学龄儿童,其特征是持续发烧、全身性炎症和多系统器官功能障碍。2019 冠状病毒病(COVID-19)流行期间,MIS-C是引起患者死亡常见原因之一[29]。
首先,KD与MIS-C发病年龄不同,前者年龄多小于5岁,以6月龄至1岁的婴儿多见,后者的平均发病年龄更高,主要分布在6~15岁。
KD多为皮肤黏膜表现、
易误诊人群
1. 无基本表达能力,临床症状描述不清婴幼儿患者。
2. 临床症状不典型的iKD患儿
本病被误诊为其他疾病
本病常被误诊为其他感染性和免疫性疾病,如
其他疾病被误诊为本病
1. 布鲁氏杆菌病。
2. 组织细胞坏死性淋巴结炎。
避免误诊的要点
由于KD临床表现无特异性,临床诊断需排除
故在临床实践中,应做到以下几点:
● 加强对KD及其相关疾病知识的了解及学习,掌握KD临床表现、诊断及鉴别诊断要点,仔细进行鉴别诊断,必要时需完善各项相关检查,以利于疾病正确诊断。
● 临床接诊
● 临床医生在接诊患儿时应仔细询问病史和病程,重视患儿的伴随症状,仔细全面分析病情,不能单凭患儿的主诉和相关医技检查结果进行诊断。
● 接诊医生还需了解患儿既往居住环境以及生活饮食习惯,这对于一些传染性疾病的鉴别诊断十分重要。
因KD目前病因及发病机制不明,暂无法做到有效预防,但如果能做到以下几个方面,可在一定程度上可减少KD的发生。
● 保证充足的营养,以富含维生素和蛋白质的清淡、易消化的食物为主,提高机体的免疫力。
● 保持良好心态,良好的情绪对人体免疫力有积极的作用,若心态良好,人体免疫力相对较高,可有效预防疾病的发生。
● 养成良好的生活习惯,做到起居有常,保证充足睡眠,劳逸结合,防止睡眠不足导致身体劳累、虚弱。
● 积极参加体育锻炼,增加心肺功能,增强体质,进而提升身体免疫力。
● 做好防治措施,日常应做好保暖措施,特别是天气变化时,应注意衣物的增减,以免由于经常寒凉导致感冒发生。应避免经常到人流密集的公共场所活动以免发生疾病的感染。
● 定期体检及时了解身体情况。早期发现异常的情况,可以采取积极的措施,以免出现失治、误治。
KD临床症状的恢复时间需2~4周,炎性指标变化的恢复时间在6~8周,根据KD病情轻重不同,孩子恢复时间也因人而异。部分孩子临床表现随着体温消退,可能出现结膜充血消退,口唇皲裂逐渐恢复,手指硬肿逐渐恢复,
KD随访管理目的在于尽可能地预防心血管事件的发生(如心肌缺血、心肌梗死及猝死等)。 关于KD的随访管理,日本循环学会建议如下:
● 冠状动脉无扩张或者一过性扩张者需随访5年,分别于发病后1个月、2个月、6个月、1年及5年进行心电图以及
● 中小冠状动脉瘤在发病1月后甚至1~2年内病变恢复者需要每年进行心电图及
● 巨大冠状动脉瘤不能恢复者可能发生心肌缺血,必须密切随访,选择性使用
● 冠状动脉狭窄伴或不伴心肌缺血:需终生随访,每3~6个月进行1次专科评估,持续口服小剂量阿司匹林,加用钙离子拮抗剂、ACEI或者β受体阻滞剂等以预防心肌缺血及心衰的发生,必要时行冠状动脉旁路移植术或者经皮冠状动脉介入治疗术。
关于KD患儿的健康教育应注意以下几个方面:
1. 保持病室空气清新,温湿度适宜,急性期有冠状动脉损害时卧床休息。
2.体温<38.5℃,给患儿多饮水,或酌情考虑温水擦浴,冰袋冷敷;体温>38.5℃时,遵医嘱应用退热药物,多饮水,出汗及时擦干,更换衣物。避免因高热引起惊厥。
3. 给予清淡的高热量、高维生素、高蛋白质的流质或半流质饮食(如面条,米粥等),鼓励患儿多饮水,避免进食硬性食物(如坚果、饼干等)时损伤胃,肠黏膜引起出血。
4. 保持皮肤清洁,每天清洗患儿皮肤,剪短指甲,以免抓伤和擦伤;衣服质地柔软而清洁,每次便后清洗臀部;对半脱的皮肤用干净剪刀剪除,切忌强行撕脱,防止出血和继发感染。
5. 每日晨起、睡前、餐前、餐后漱口,以保持口腔清洁,防止继发感染与增进食欲。口唇干裂者可涂护唇油或香油,遵医嘱给予药物涂擦口腔创面。
6. 保持眼部的清洁,遵医嘱每日用生理盐水洗眼1~2次,以预防感染。
本站内容仅供医学专业人士参考
不能作为诊断及医疗依据,请谨慎参阅
©医知源 版权所有,未经许可,不得以任何形式对医知源内容和插图进行转载使用。



 长按文字
长按文字