


重症肌无力(myasthenia gravis,MG)是一种自身抗体介导、细胞免疫依赖、补体参与,累及神经-肌肉接头(neuromuscular junction,NMJ)突触后膜,引起神经-肌肉接头传递障碍的获得性自身免疫性疾病。
尽管MG被认为是目前认识最充分且治疗效果最好的自身免疫性疾病之一。但在发病机制方面仍存在争议。目前研究表明MG为抗体介导、细胞免疫依赖、补体参与的NMJ信号传递障碍性自身免疫病。
MG患者肌无力症状特别是在早期具有明显的波动性,不仅表现为一天中的晨轻暮重,也可表现为一个时间阶段内的波动,病程长的患者肌无力症状波动性可能不明显。肌无力一般从一组肌群开始,逐渐累及到其他肌群,后期可出现全身肌无力;少数患者短期内出现全身肌肉收缩无力,甚至发生
MG患者预后较好,少数患者经治疗后可完全缓解,大部分患者可药物维持症状缓解,绝大多数疗效良好的患者可进行正常的学习、生活和工作。
重症肌无力(myasthenia gravis,MG)是一种自身抗体介导、细胞免疫依赖、补体参与,累及神经-肌肉接头(neuromuscular junction,NMJ)突触后膜,引起神经-肌肉接头传递障碍的获得性自身免疫性疾病。
MG是目前认识最充分且治疗效果最好的自身免疫性疾病之一。其特征性临床表现为受累骨骼肌无力和易疲劳,症状波动,即活动后肌力明显减退,经休息或应用胆碱酯酶抑制剂后症状减轻。最常受累的肌肉包括眼肌、四肢肌、呼吸肌和延髓支配肌[1, 2]。既往MG患者病死率高,因此被命名为“重症”。但随着医疗科技发展目前MG的年病死率仅为(0.06~0.89)/100万。
MG是最常见的累积神经-肌肉接头的疾病。
MG年发病率(4~21.3)/100万[1, 2]。我国MG发病率约为6.8/100万,女性发病率大于男性,约为3:2,南方地区地区发病率较北方地区高。
MG患病率为(77~250)/100万,可发生于任何年龄及人种,但亚洲青少年中的发生率略高。20~40岁和50~70岁左右呈现发病双峰,但我国儿童及青少年MG患病高达50%[3]。
目前MG的年病死率仅为(0.06~0.89)/100万,主要死亡原因为呼吸衰竭、肺部感染等[4]。
MG为获得性自身免疫性疾病,具体发病原因尚不明确,普遍认为与感染、药物、环境因素、手术等相关。
同时MG患者中65%~80%有胸腺增生,10%~20%伴发
多种因素及药物与MG的恶化有关,应尽可能避免使用,若绝对需要时谨慎使用并密切监测患者病情变化。
常见诱因有劳累、吸烟、饮酒、感染、外伤或手术、精神创伤、全身性疾病、月经来潮、妊娠、分娩、情绪激动[10]、焦虑抑郁[11]、预防接种等。
1.抗生素
庆大霉素、链霉素、新霉素、卡那霉素、四环素、氨苄青霉素、妥布霉素、多粘菌素等均有神经-肌肉传递阻滞作用。
2.心血管疾病药物
如普萘洛尔、利多卡因、奎尼丁、普鲁卡因酰胺、维拉帕米等。
3.抗
如苯妥英钠、乙琥胺等。
4.抗精神病药
包括碳酸锂、苯乙肼、氯丙嗪、氯硝西泮、地西泮(特别是注射剂)。
5.麻醉药
如吗啡、乙醚、氯仿。如果手术必须麻醉时可选择环丙烷、氟烷、氧化亚氮、琥珀胆碱等。
6.其他药物
青霉胺、奎宁、氯奎、含碘的造影剂以及肉毒毒素等。
尽管MG被认为是目前认识最充分且治疗效果最好的自身免疫性疾病之一。但在发病机制方面仍存在争议。
目前研究表明MG为抗体介导、细胞免疫依赖、补体参与的NMJ信号传递障碍性自身免疫病。正常情况下,肌肉疲劳是由于连续收缩过程中ACh释放逐渐减少所致,而MG的肌无力或肌肉病态疲劳是由于NMJ突触后膜AChR减少导致传递障碍[12]。
在正常情况下,ACh与AChR结合后可产生足以使肌纤维收缩的终板电位使肌肉收缩。然而,在MG中,NMJ处AChR数量减少,使终板电位无法形成有效的肌纤维动作电位,运动终板传递受阻,肌肉收缩力减弱。这种现象首先出现在运动频率高、AChR相对较少的眼肌和颅神经支配肌。
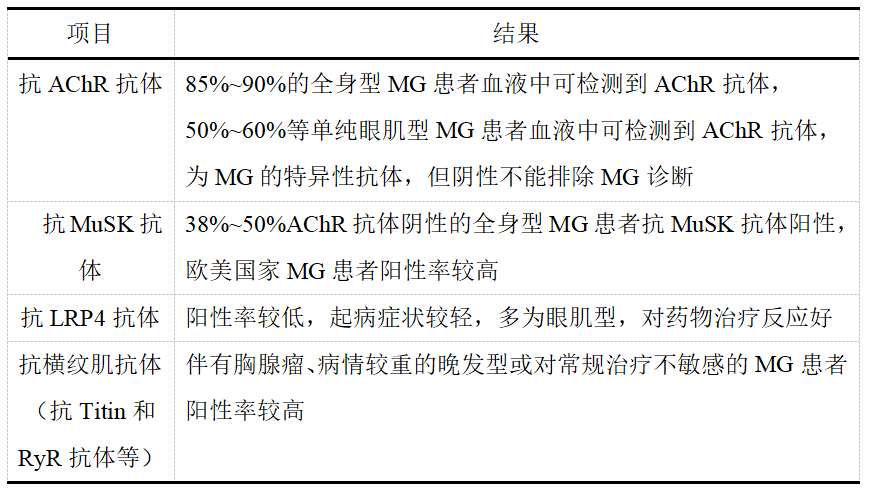
有研究表明MG的基本缺陷在于NMJ突触后膜上AChR缺乏,同时在实验性MG动物血清中发现AChR抗体,用免疫荧光法观察到突触后膜上AChR与AChR抗体及补体的免疫复合物沉积。此外,MG患者的肌肉活检也表明AChR明显减少,从而证实AChR抗体的致病性,为MG自身免疫学说提供有力证据。约85%~90%的全身型MG及50%~60%的眼肌型MG患者可检出AchR抗体,母亲为MG患者的新生儿也可发现AChR抗体,使该AChR抗体成为诊断MG敏感可靠的指标。
但目前研究显示AChR抗体水平与MG严重程度无相关性,因此研究者还需继续寻找可能与MG呈正相关的其他因素(如,继发生成的细胞因子、其他肌肉抗体、趋化因子等)[13]。
遗传因素也可能参与了MG的发病,现已发现某些HLA类型(如HLA-B8、DRw3和DQw2)与肌无力有关[14]。
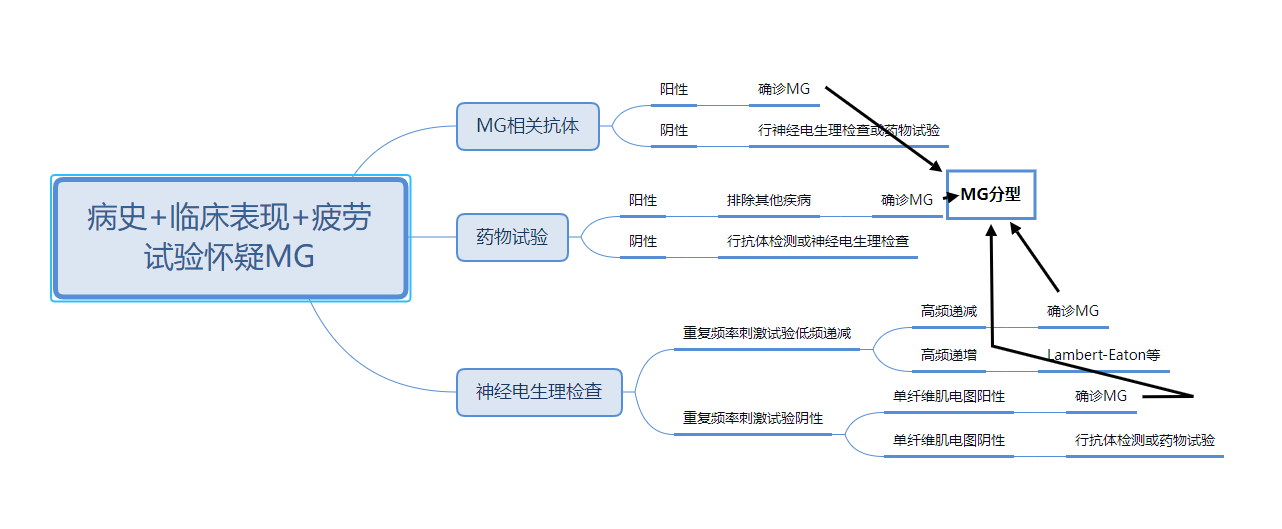
图1 重症肌无力诊断流程[17]
MG患者临床特点鲜明,详询的病史和查体是诊断的关键。
询问有无活动后加重休息或应用胆碱酯酶抑制剂后肌无力症状明显缓解。有无
有无甲状腺功能亢进及其他自身免疫性疾病;有无肿瘤病史。
有无烟酒嗜好。有无肉毒中毒、氨基类药物、有机溶剂及重金属等接触或中毒病史。
家族中有无类似病史及其他自身免疫性疾病,直系亲属中有无近亲婚姻。
MG患者肌无力症状特别是在早期具有明显的波动性,不仅表现为一天中的晨轻暮重,也可表现为一个时间阶段内的波动,病程长的患者肌无力症状波动性可能不明显。
肌无力一般从一组肌群开始,逐渐累及到其他肌群,后期可出现全身肌无力;少数患者短期内出现全身肌肉收缩无力,甚至发生
表1 MG患者不同肌群受累症状
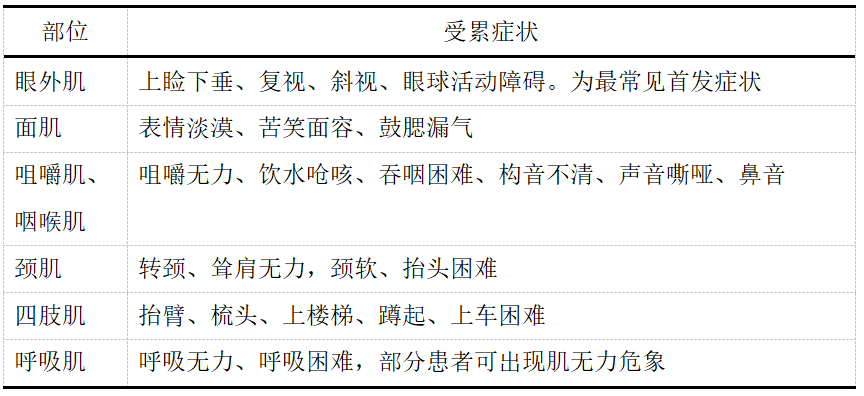
MG患者的肢体肌无力主要累及近端肌群,少部分患者可出现远端肌无力。典型表现为疲劳性肌无力,长时间或重复运动可使肌无力加重。
临床医生可以根据患者的主诉选择做睁闭眼、持续上视、上肢平举、蹲起等动作。
患者可表现为眼睑下垂、眼球活动障碍和复视等,但瞳孔对光反射完整。眼睑下垂患者可闭眼休息数分钟后症状减轻。
患者可有延髓肌受累表现,包括咀嚼无力、构音不清、头下垂、吞咽费力等。轻度延髓肌受累者,让患者大声朗读后可出现构音不清,持续用力咬牙后可出现咀嚼肌无力,平卧抬头可出现颈部肌肉无力。
患者可有四肢肌受累表现,依次检查各关节,并对抗检查者所给予的阻力,观察肌力是否正常,是否有易疲劳现象,观察肌无力的部位和程度,包括上肢抬举无力、蹲起无力。轻度受累者,双上肢平举,数分钟后出现上肢下垂;直腿抬高可见腿下垂。
患者可有呼吸肌受累,出现
疲劳试验阳性,尽管该方法是否阳性带有一定的主观因素,但仍能甄别出大多数的新发MG。无感觉障碍、病理征、肌萎缩、肌痛、腱反射增强。
可伴有胸腺增生、
常用的辅助检查有:血清抗体检测、药物试验及神经电生理检查。其中血清抗体检测特异性最高,药物试验及神经电生理检查仅提示神经肌肉接头存在病变,需结合临床综合判断。
药物试验:胆碱酯酶抑制剂能缓解或减轻MG病人的临床症状和电生理异常,最常用的新斯的明试验和腾喜龙试验。
冰袋试验操作简单、安全,对于疑为MG的上睑下垂患者,嘱患者双眼向前平视,测量瞳孔中轴线上的上下眼睑边缘之间的距离,即睑裂。然后用纱布包裹冰袋,置于上眼睑上方2分钟,冰敷完毕后迅速地再次测量睑裂大小。
增加2mm以上为阳性。这种改善是暂时的,持续大约7分钟。
是最经典、易行、价廉的临床辅助检查。具体方法:肌肉注射新斯的明,成人为1~1.5mg,儿童为0.02~0.03mg/kg,同时肌肉注射阿托品0.5mg,在注射前及注射后20、30、40、50、60min观察症状及体征变化。依照相对评分作为试验结果。相对评分=(试验前该项记录评分-注射后每次记录评分)/试验前该项记录评分×100%。
≥60%为阳性,25%~60%为可疑阳性,≤25%为阴性,但本试验阴性不能排除MG。
腾喜龙可引起轻度
MG患者用药后,肌无力症状在30s内得到纠正,1~2min回到基线水平。而正常人用药后肌力无改变。
在全身型MG患者中其阳性率可达90%,但在眼肌型MG患者中的阳性率仅30%~50%,因此结果阴性不能排除MG诊断。需要注意的是服用胆碱酯酶抑制剂的患者应停药12~18小时。
低频(低于10Hz/s)或高频(高于10Hz/s)刺激,肌肉诱发电位的波幅均递减。低频递减超过10%,高频递减超过30%以上者为阳性。
在MG诊断中具有重要价值,可检测面神经、副神经、腋神经、尺神经等。
单纤维
单纤维
单根纤维针电极插在同一运动神经支配的二根肌纤维之间。两个活动电位之间潜伏期的颤抖延长>50μs者为阳性。
MG抗体检测是MG的重要检查手段,包括抗AChR抗体、抗MuSK抗体、抗LRP4抗体、抗Titin和RyR抗体以及抗核抗体和甲状腺抗体等(表2)。
需要注意的是,由于各检测机构MG抗体检测的方法不同,结果也不尽一致,存在着一定比例的假阳性和假阴性,此外还有未被发现的抗原抗体。
表 2 MG相关抗体
胸部CT诊断胸腺异常准确率达94%,胸部CT能发现较小的胸腺肿瘤,可鉴别囊性或实性,有无钙化,有无侵犯胸膜、肺及大血管等恶性肿瘤的指征。常规胸部平片对
激素治疗前应常规行胸部CT或平片检查除外结核可能。另外为了了解有无胸腺增生或胸腺肿瘤。
必要时进一步查磁共振检查和PET-CT。根据病情需求,可进行多方位和多角度检查,无X线辐射,无骨伪影干扰,是一种无损伤性检查,但磁共振空间分辨率不如X线胸片,也比不上CT,肺部的小结节不能显示,对钙化显示不如CT和X线,并且磁共振对部分病变缺乏特异性。
胸部磁共振检查易于显示纵隔肿瘤及其与血管间的解剖关系,甚至可以了解病灶侵袭组织的程度,病灶的空间位置具有显著优势,可评估手术结果。
PET-CT将肿瘤的诊断正确率提高到95%~99%,可用于恶性肿瘤的诊断以及良恶性病变的鉴别诊断,但该检查价格昂贵,多数医院无相关设备,且辐射剂量较大,所以应该在有充分的临床理由后去做PET-CT检查。
在具有典型MG临床特征(肌无力波动性及易疲劳)的基础上,满足以下3点中的任意一点阳性即可做出诊断,包括:①药物试验;②电生理学检查;③血清MG抗体检测[19]。
同时需排除其他疾病(如Miller Fisher综合征、慢性进行性眼外肌麻痹、眼咽型肌营养不良、Lambert-Eaton综合征、Guillain-Barré综合征、肉毒中毒、慢性炎性脱髓鞘性多发性神经病、
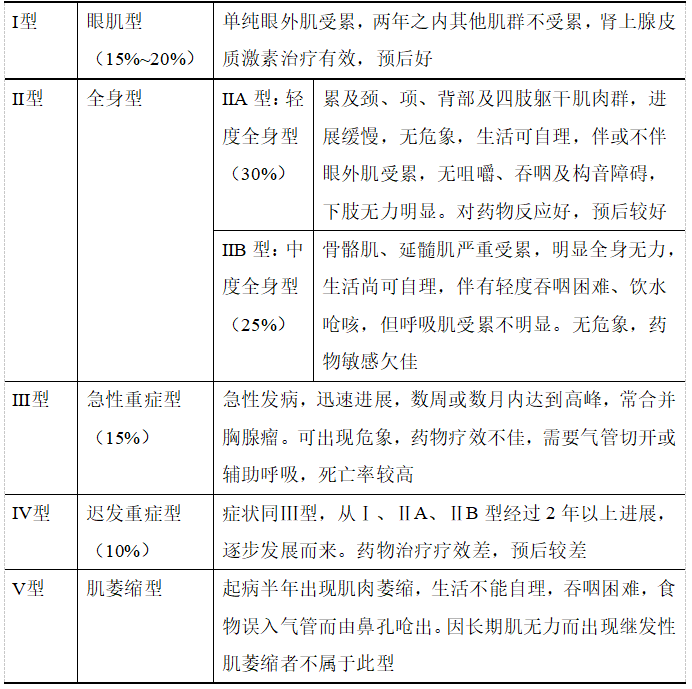
1. Osserman分型
1958年Osserman将成人MG根据受累部位、严重程度、疾病进展和预后等进行分型,故称Osserman分型[20](表3)。后又将Ⅱ型分为Ⅱa和Ⅱb两种类型,并取消肌萎缩型,为改良的Osserman标准。
表3 Osserman分型
此外还有儿童型MG和少年型MG,儿童型占我国MG患者的10%,大部分仅累及眼外肌,少数累及全身骨骼肌。儿童型还有两种特殊类型:新生儿型和先天型,新生儿型临床多表现为哭声低、吸吮无力、动作减少等,经治疗后多在一周至3个月缓解;先天型临床多表现为出生后短暂出现肌无力、对胆碱酯酶抑制剂药物效果不佳,但进程缓慢,可有家族史。少年型MG一般在10岁后发病,多为单纯的眼外肌麻痹,少数伴有
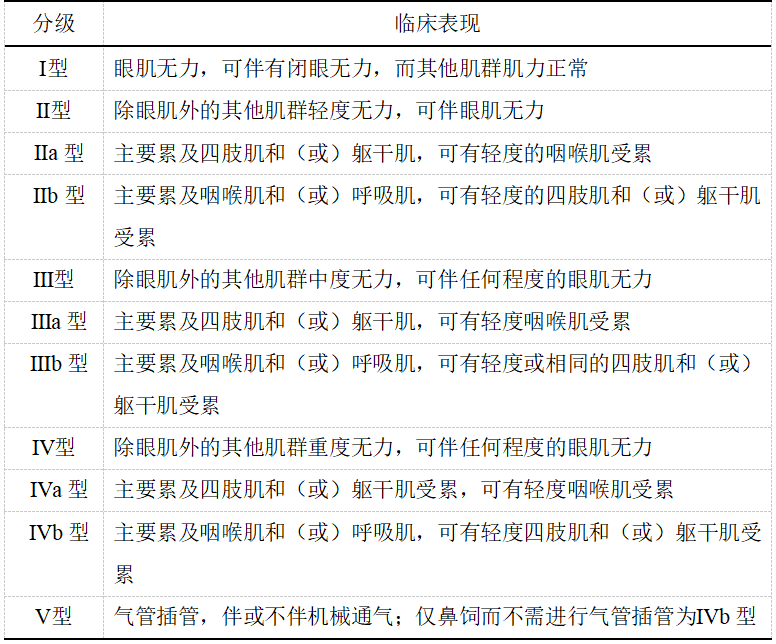
2.美国重症肌无力基金会(Myasthenia Gravis Foundation of America,MGFA)临床分型
开展MGFA临床分型[21](表4)的目的是评估疾病严重程度。
表4 MGFA临床分型
3. MG亚组分类
1980年Compston等[22]根据胸腺病理学及发病年龄将MG分成3种亚型,之后随着检测技术发展,在《中国重症肌无力诊断和治疗指南(2020版)》中提出MG亚组分类(表5),指导精准化治疗,提醒临床医生注意其他器官并发症的出现。
表5 MG亚组分类及临床特点
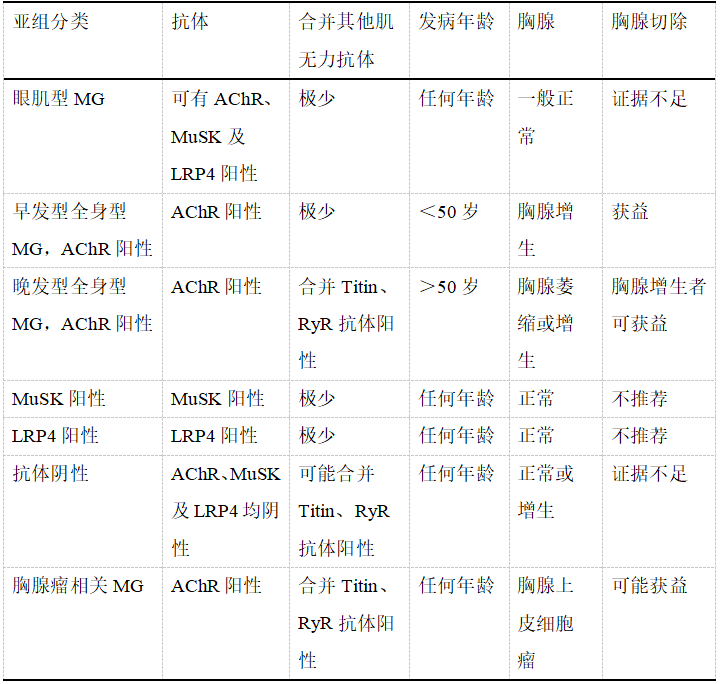
总结来说,Osserman分型便于临床识别患者受累部位和疾病进程,操作简单,但主观性强,临床症状与分型关系并非绝对,存在各类型间转化的中间带;MGFA分型更为简便,对MG患者进行问卷量化,相对较为客观;MG亚组分类可根据不同亚群指导不同的治疗方案,对患者治疗与预后有重要意义。
MG在治疗过程中或起病时就出现
MG是可治性疾病,根据临床特点对大多数MG的诊断并不困难,但在临床工作中,仍需与以下疾病相鉴别。
一般发病年龄较大,患者经常表现为过度瞬目动作,与MG相似,但眼睑痉挛通常为双侧,不伴复视,可伴有眼部干燥、刺激感,在触摸眼角、
伴有瞳孔扩大的
属于Guillain-Barré综合征变异型,MFS的主要表现为急性眼肌麻痹、
新斯的明试验呈阴性,脑脊液检查有蛋白-细胞分离,部分病人血清中可检测到抗GQ1b抗体或GT1a抗体。
部分Horner征患者可以仅表现为眼裂变窄和瞳孔收缩,而没有明显的眼球内陷和额部出汗。因此,在面对上睑下垂就诊的病人时,务必注意瞳孔。如果没有其他原因可以解释上睑下垂侧瞳孔缩小,就应考虑不完全Horner征的可能性。
为先天性肌无力综合征中的一种,通常出生后即存在,多在出生时、婴幼儿时期出现眼睑下垂、喂养困难及运动发育迟滞等症状,多为单侧,不伴有复视,症状无波动性。
易被误诊为抗体阴性的MG。青春期逐渐出现眼球固定,在临床及电生理表现与MG类似,鉴别依靠血清学抗体检测及全外显子测序结果。
中脑或脑桥病变可出现眼肌麻痹,若累及中脑动眼神经核团可表现为分离性眼肌麻痹,需与MG鉴别。
结合病史、查体、头MRI以及特异性抗体检测有助于明确诊断。
老年性上睑下垂通常由于提上睑肌萎缩无力引起,可出现上睑下垂遮盖瞳孔。与MG不同,老年性上睑下垂患者没有症状波动性特点,而是缓慢加重,且多数为双侧,不伴有复视。
必要时可进行疲劳试验和新斯的明试验进行鉴别。
属线粒体脑肌病,线粒体肌病或线粒体脑肌病临床表现以骨骼肌易疲劳为主,轻度活动后即感到疲乏,休息后可好转等特征。由于病史中可能存在波动性的骨骼肌肌无力表现,常被误诊为MG。
CPEO主要表现为双侧进展性无波动性上睑下垂、眼外肌麻痹,部分患者可伴有肌无力。如果同时合并心脏传导阻滞、
CPEO或KSS综合征血乳酸轻度增高,
为常染色体显性遗传病,中年起病,起病隐匿,部分有家族史,可有眼睑下垂、眼肌麻痹、
呈“挤眉弄眼”样,双眼睑痉挛是本病最常见的首发症状,眼睑无力和眼睑下垂也很常见。有少部分患者单眼起病,逐渐发展为双侧,先出现眼
常伴有
神经重复电刺激可见低频刺激递减大于10%;高频刺激可出现100%甚至以上的递增。血清VGCC抗体多为阳性,合并
为急性炎性脱髓鞘性周围神经病,表现为肢体无力、感觉减退、腱反射减低或消失。
脑脊液检查可见蛋白-细胞分离,血清抗GT1a抗体、GQ1b抗体可呈阳性。新斯的明试验阴性。
多种原因导致的骨骼肌间质性炎性病变,表现为进行性加重的四肢无力,与以肢体肌无力为主的MG临床表现相似,约1/3的炎性肌病患者可伴肌痛。
炎性肌病肌酶高,
新斯的明试验阴性,电生理可帮助对两者鉴别。
是一组罕见的由编码NMJ的基因突变所致NMJ传递障碍的遗传性疾病,根据突变基因编码蛋白在NMJ的分布,先天性肌无力综合征可分为突触前、突触以及突触后突变。先天性肌无力综合征临床表现异质性很大,易被误诊为抗体阴性的MG。
先天性肌无力综合征
由肉毒杆菌毒素累及NMJ突触前膜所致,主要表现为眼外肌麻痹以及构音、吞咽、咀嚼无力,瞳孔扩大和对光反射迟钝、四肢腱反射消失、突出的自主神经症状,可累及呼吸肌。
电生理检查低频重复电刺激可见波幅递减,高频重复电刺激波幅递增度。
为免疫介导的慢性运动感觉周围神经病,表现为感觉减退,腱反射减低或消失。
表现为四肢无力,不能耐受疲劳,腱反射减低或消失,同时伴有其他器官损害。
易误诊人群
MG误诊误治现象在临床上并不少见。尤其在老年人群中更多见。
老年人可能出现皮肤松弛导致上睑下垂、视野变小,眼肌型MG患者早期出现此类表现易被误认为是生理性或眼部疾病。
老年人是脑血管疾病高发人群,若全身型MG患者早期出现四肢无力表现易被误认为是脑血管疾病。
另外,老年人会出现免疫力下降且同时合并其他多种疾病,因此老年MG患者病情更复杂,确诊更困难。
本病被误诊为其他疾病
1.
2. 糖尿病性眼肌麻痹
3. 代谢性肌病。
其他疾病被误诊为本病
1. 线粒体肌病或线粒体脑肌病
2.神经系统副肿瘤综合征
3.糖尿病性眼肌麻痹
4.眼外肌瘫痪
5.脑干梗死
6.甲状腺相关眼病
7.
避免误诊的要点
1. 临床上对考虑诊断MG患者应详细询问病史,结合新斯的明试验、重复神经电刺激等多种检查联合诊断,并行血清学抗体检查。
2.病史中最重要的是肌无力的分布及波动性,MG绝大部分以眼肌起病,因此当临床医生碰到上睑下垂和复视的患者都会考虑到MG,但若以其他肌群起病,特别是仅有肢体肌无力起病时就容易漏诊。
1. 避免过度劳累,受凉,不宜在烈日下过久。
2. 恰当治疗MG,如从小剂量胆碱酯酶抑制剂开始,逐渐增加剂量。
3. 避免使用使MG加重的药物。
4. 保持环境舒适,避免精神紧张,必要时可心理干预。
MG患者预后较好,少数患者经治疗后可完全缓解,大部分患者可药物维持症状缓解,绝大多数疗效良好的患者可进行正常的学习、生活和工作。
根据MG的症状以及疾病进展快慢调整相应的随访时间。
(一) 关于疾病知识的教育
对于初次诊断MG的患者及其家庭成员进行关于MG诊断和治疗方面知识的教育,有助于其充分认识并学会如何应对这个疾病。
(二) 关于生活方式管理的教育
主要包括保证充足睡眠避免过度劳累,注意保暖避免受凉,饮食忌食辛辣油腻,避免感染、外伤和情绪激动等,不宜在烈日下过久,以防MG加重。女生月经期如症状加重需及时就医调整用药方案。在开始尝试怀孕前请先告知医护人员,怀孕有可能加重MG。某些药物可使MG加重,使用任何药物(包括非处方药)之前请先告知医护人员,应询问该药对MG患者是否安全。
(三) 关于诊疗依从性的教育
主要包括按照医嘱规律服药,警惕药物副作用,定期随诊复查,评估治疗效果及疾病进展等。
本站内容仅供医学专业人士参考
不能作为诊断及医疗依据,请谨慎参阅
©医知源 版权所有,未经许可,不得以任何形式对医知源内容和插图进行转载使用。



 长按文字
长按文字